Asidong amino: Pagkakaiba sa mga binago
cite reference. |
|||
| Linya 2: | Linya 2: | ||
[[Image:Amino Acids.svg|thumb|upright=2.0|right|alt=Table of Amino Acids.|Ang 21 asidong amino na matatagpuan sa mga [[eukaryote]] na pinangkat ayon sa mga halagang [[pKa|pK<sub>a</sub>]] ng kanilang mga kadenang gilid at mga karga sa [[pH#Living systems|physiological pH 7.4]]]] |
[[Image:Amino Acids.svg|thumb|upright=2.0|right|alt=Table of Amino Acids.|Ang 21 asidong amino na matatagpuan sa mga [[eukaryote]] na pinangkat ayon sa mga halagang [[pKa|pK<sub>a</sub>]] ng kanilang mga kadenang gilid at mga karga sa [[pH#Living systems|physiological pH 7.4]]]] |
||
Ang mga '''asidong amino'''<ref>{{cite web |url=http://www.glencoe.com/sec/science/mlg/mss/Tagalog_ms_A.pdf |title=Tagalog Glossary: A |work=Multilingual Glossary, Middle School Glossary, Science |publisher=Glencoe/McGraw-Hill |accessdate=2013-11-11}}</ref> o '''amino acid''' ang mga [[kompuwestong organiko]] na mahalaga sa [[biyolohiya]] na gawa mula sa mga [[functional group]] na [[amine]] (-NH<sub>2</sub>) at [[carboxylic acid]] (-COOH) kasama ng isang [[kadenang gilid]] na spesipiko sa bawat asidong amino. Ang mga mahahalagang elemento ng asidong amino ang [[carbon]], [[hidroheno]], [[oksiheno]], at [[nitroheno]] bagaman ang ilang mga elemento ay matatagpuan sa mga kadenang gilid ng ilang mga asidong amino. Ang mga 500 asidong amino ay alam <ref>{{cite journal |title= New Naturally Occurring Amino Acids |first1= Ingrid |last1= Wagner |first2= Hans |last2= Musso |doi= 10.1002/anie.198308161 |journal= Angew. Chem. Int. Ed. Engl. |volume= 22 |issue= 22 |pages= 816–828 |month= November |year= 1983 }}</ref> at mauuri sa maraming mga paraan. Sa istruktura, sila ay mauuri ayon sa mga lokasyon ng mga functional group bilang mga asidong amino na [[Alpha and beta carbon|alpha- (α-), beta- (β-), gamma- (γ-) or delta- (δ-)]]. Ang ibang mga kategorya ay nauugnay sa [[polaridad na kimikal]], lebel ng [[pH]] at uri ng pangkat na kadenang gilid ([[aliphatic]], asikliko, aromatiko, naglalaman ng hydroxyl o sulfur, etc.) Sa anyo ng mga protina, ang mga asidong amino ay bumubuo pinakamalaking sangkap (pagkatapos ng tubig) ng mga muscle, mga selula at mga tisyu ng tao.<ref>[http://www.fao.org/docrep/W0073E/w0073e04.htm#P1625_217364 Human nutrition in the developing world] – [[United Nations]] [[Food and Agriculture Organization]], ch.8</ref> Ang mga asidong amino na nag-aangkin ng parehong mga pangkat na amine at asidong carboxylic na nakakabit sa atomong [[alpha-carbon|una (alpha-) carbon]] ay may partikular na kahalagahan sa [[biyokimika]]. Ang mga ito ay kilala bilang '''2-, alpha-,''' o '''α-amino acid''' (henerikong pormula H<sub>2</sub>NCHRCOOH in most cases<ref>[[Proline]] is an exception to this general formula. It lacks the NH<sub>2</sub> group because of the [[cyclization]] of the side-chain and is known as an [[imino acid]]; it falls under the category of special structured amino acids.</ref> kung saan ang R ay isang organikong [[substituent]] na kilala bilang "[[side-chain]]");<ref>[http://www.chemguide.co.uk/organicprops/aminoacids/background.html – INTRODUCING AMINO ACIDS]</ref>. Kadalasan, ang katagang "asidong amino" ay ginagamit upang spesipikong tumukoy sa mga ito. Ito ay kinabibilangan ng mga 23 [[Proteinogenic amino acid|proteinogenic]] ("nagtatayo ng protina") asidong amino na naghahalo tungo sa mga kadenang [[peptide]] ("polypeptides") upang bumuo ng mga pantayong bloke ng isang malaking bilang ng mga protina.<ref name="NIGMS">{{cite web| url = http://publications.nigms.nih.gov/structlife/chapter1.html | title = The Structures of Life | publisher = National Institute of General Medical Sciences | accessdate = 20 May 2008}}</ref> Ang lahat ng ito ay mga L-[[stereoisomerism|stereoisomer]] ("[[Chirality (chemistry)|kaliwang panig]]" na mga [[isomer]]) bagaman ang ilang mga D-amino acid ("kanang panig") ay nangyayari sa mga [[envelope ng bakterya]] at ilang mga [[antibiyotiko]].<ref>"Biochemical pathways: an atlas of biochemistry and molecular biology" – Michal, p.5</ref><ref>{{cite web|url=http://www.cliffsnotes.com/study_guide/Amino-Acids.topicArticleId-24998,articleId-24958.html |title=Biochemistry I: Amino Acids |publisher=Cliffsnotes.com |date= |accessdate=9 November 2012}}</ref> Ang 20 sa 23 asidong amino na proteinogenic ay tuwirang kinokodigo ng mga triplet [[codon]] sa [[kodigong henetiko]] at kilala bilang mga pamantayang asidong amino. Ang ibang tatlo(na hindi pamantayan o hindi kanonikal) ay [[pyrrolysine]] (na matatagpuan sa mga organismong [[metanoheniko]]at ibang mga [[eukaryote]]), [[selenocysteine]] (na umiiral sa maraming mga hindi eukaryote gayundin sa karamihan ng mga eukaryote), at[[N-Formylmethionine]]. Halimbawa, ang 25 na protinang pantao ay kinabibilangan ng selenocysteine (Sec) sa kanilang pangunahing istruktura,<ref>Kryukov GV, Castellano S, Novoselov SV, Lobanov AV, Zehtab O, Guigo R, et al. Characterization of mammalian selenoproteomes. Science. 2003;300:1439–1443.</ref> at ang mga inilalarawan sa istrukturang mga enzyme (selenoenzyme) ay gumagamit ng Sec bilang katalitikong [[moiety (chemistry)|moiety]] sa kanilang mga aktibong lugar.<ref>Gromer, S., Urig, S., Becker, K. (2004) The Thioredoxin System - From Science to Clinic. Medicinal Research Reviews. 24(1):40-89.</ref> Ang Pyrrolysine at selenocysteine ay kinokodigo sa pamamagitan ng mga bersiyong codon. Halimbawa, ang selenocysteine ay kinokodigo ng [[stop codon]] at [[elementong SECIS]].<ref>[http://books.google.com/books?id=BDn-AI_YBlMC&pg=PA1&lpg=PA1&ots=WSsFhHJwDy&sig=jkSLFr7AK8iu6OhdX7KOc10eKRY&hl=en&sa=X&ei=gshLUOWZLIin0AXRm4GoBg Modeling Electrostatic Contributions to Protein Folding and Binding] – Tjong, p.1 footnote</ref><ref>[http://books.google.com/books?id=VoJw6fIISSkC&pg=PA299&lpg=PA299&ots=C20L115r05&sig=4cix7yKNlod3xbzy2TWiOzEe6As&hl=en&sa=X&ei=H81LUL6MOfC10QX4wYG4Cw&ved=0CIcBEOgBMA8 Frontiers in Drug Design and Discovery] ed. Atta-Ur-Rahman & others, p.299</ref><ref name="url_The_Genetic_Codes_NCBI">{{cite web | url = http://www.ncbi.nlm.nih.gov/Taxonomy/Utils/wprintgc.cgi?mode=c | title = The Genetic Codes | author = Elzanowski A, Ostell J | authorlink = | |
Ang mga '''asidong amino'''<ref>{{cite web |url=http://www.glencoe.com/sec/science/mlg/mss/Tagalog_ms_A.pdf |title=Tagalog Glossary: A |work=Multilingual Glossary, Middle School Glossary, Science |publisher=Glencoe/McGraw-Hill |accessdate=2013-11-11}}</ref> o '''amino acid''' ang mga [[kompuwestong organiko]] na mahalaga sa [[biyolohiya]] na gawa mula sa mga [[functional group]] na [[amine]] (-NH<sub>2</sub>) at [[carboxylic acid]] (-COOH) kasama ng isang [[kadenang gilid]] na spesipiko sa bawat asidong amino. Ang mga mahahalagang elemento ng asidong amino ang [[carbon]], [[hidroheno]], [[oksiheno]], at [[nitroheno]] bagaman ang ilang mga elemento ay matatagpuan sa mga kadenang gilid ng ilang mga asidong amino. Ang mga 500 asidong amino ay alam <ref>{{cite journal |title= New Naturally Occurring Amino Acids |first1= Ingrid |last1= Wagner |first2= Hans |last2= Musso |doi= 10.1002/anie.198308161 |journal= Angew. Chem. Int. Ed. Engl. |volume= 22 |issue= 22 |pages= 816–828 |month= November |year= 1983 }}</ref> at mauuri sa maraming mga paraan. Sa istruktura, sila ay mauuri ayon sa mga lokasyon ng mga functional group bilang mga asidong amino na [[Alpha and beta carbon|alpha- (α-), beta- (β-), gamma- (γ-) or delta- (δ-)]]. Ang ibang mga kategorya ay nauugnay sa [[polaridad na kimikal]], lebel ng [[pH]] at uri ng pangkat na kadenang gilid ([[aliphatic]], asikliko, aromatiko, naglalaman ng hydroxyl o sulfur, etc.) Sa anyo ng mga protina, ang mga asidong amino ay bumubuo pinakamalaking sangkap (pagkatapos ng tubig) ng mga muscle, mga selula at mga tisyu ng tao.<ref>[http://www.fao.org/docrep/W0073E/w0073e04.htm#P1625_217364 Human nutrition in the developing world] – [[United Nations]] [[Food and Agriculture Organization]], ch.8</ref> Ang mga asidong amino na nag-aangkin ng parehong mga pangkat na amine at asidong carboxylic na nakakabit sa atomong [[alpha-carbon|una (alpha-) carbon]] ay may partikular na kahalagahan sa [[biyokimika]]. Ang mga ito ay kilala bilang '''2-, alpha-,''' o '''α-amino acid''' (henerikong pormula H<sub>2</sub>NCHRCOOH in most cases<ref>[[Proline]] is an exception to this general formula. It lacks the NH<sub>2</sub> group because of the [[cyclization]] of the side-chain and is known as an [[imino acid]]; it falls under the category of special structured amino acids.</ref> kung saan ang R ay isang organikong [[substituent]] na kilala bilang "[[side-chain]]");<ref>[http://www.chemguide.co.uk/organicprops/aminoacids/background.html – INTRODUCING AMINO ACIDS]</ref>. Kadalasan, ang katagang "asidong amino" ay ginagamit upang spesipikong tumukoy sa mga ito. Ito ay kinabibilangan ng mga 23 [[Proteinogenic amino acid|proteinogenic]] ("nagtatayo ng protina") asidong amino na naghahalo tungo sa mga kadenang [[peptide]] ("polypeptides") upang bumuo ng mga pantayong bloke ng isang malaking bilang ng mga protina.<ref name="NIGMS">{{cite web| url = http://publications.nigms.nih.gov/structlife/chapter1.html | title = The Structures of Life | publisher = National Institute of General Medical Sciences | accessdate = 20 May 2008}}</ref> Ang lahat ng ito ay mga L-[[stereoisomerism|stereoisomer]] ("[[Chirality (chemistry)|kaliwang panig]]" na mga [[isomer]]) bagaman ang ilang mga D-amino acid ("kanang panig") ay nangyayari sa mga [[envelope ng bakterya]] at ilang mga [[antibiyotiko]].<ref>"Biochemical pathways: an atlas of biochemistry and molecular biology" – Michal, p.5</ref><ref>{{cite web|url=http://www.cliffsnotes.com/study_guide/Amino-Acids.topicArticleId-24998,articleId-24958.html |title=Biochemistry I: Amino Acids |publisher=Cliffsnotes.com |date= |accessdate=9 November 2012}}</ref> Ang 20 sa 23 asidong amino na proteinogenic ay tuwirang kinokodigo ng mga triplet [[codon]] sa [[kodigong henetiko]] at kilala bilang mga pamantayang asidong amino. Ang ibang tatlo(na hindi pamantayan o hindi kanonikal) ay [[pyrrolysine]] (na matatagpuan sa mga organismong [[metanoheniko]]at ibang mga [[eukaryote]]), [[selenocysteine]] (na umiiral sa maraming mga hindi eukaryote gayundin sa karamihan ng mga eukaryote), at[[N-Formylmethionine]]. Halimbawa, ang 25 na protinang pantao ay kinabibilangan ng selenocysteine (Sec) sa kanilang pangunahing istruktura,<ref>Kryukov GV, Castellano S, Novoselov SV, Lobanov AV, Zehtab O, Guigo R, et al. Characterization of mammalian selenoproteomes. Science. 2003;300:1439–1443.</ref> at ang mga inilalarawan sa istrukturang mga enzyme (selenoenzyme) ay gumagamit ng Sec bilang katalitikong [[moiety (chemistry)|moiety]] sa kanilang mga aktibong lugar.<ref>Gromer, S., Urig, S., Becker, K. (2004) The Thioredoxin System - From Science to Clinic. Medicinal Research Reviews. 24(1):40-89.</ref> Ang Pyrrolysine at selenocysteine ay kinokodigo sa pamamagitan ng mga bersiyong codon. Halimbawa, ang selenocysteine ay kinokodigo ng [[stop codon]] at [[elementong SECIS]].<ref>[http://books.google.com/books?id=BDn-AI_YBlMC&pg=PA1&lpg=PA1&ots=WSsFhHJwDy&sig=jkSLFr7AK8iu6OhdX7KOc10eKRY&hl=en&sa=X&ei=gshLUOWZLIin0AXRm4GoBg Modeling Electrostatic Contributions to Protein Folding and Binding] – Tjong, p.1 footnote</ref><ref>[http://books.google.com/books?id=VoJw6fIISSkC&pg=PA299&lpg=PA299&ots=C20L115r05&sig=4cix7yKNlod3xbzy2TWiOzEe6As&hl=en&sa=X&ei=H81LUL6MOfC10QX4wYG4Cw&ved=0CIcBEOgBMA8 Frontiers in Drug Design and Discovery] ed. Atta-Ur-Rahman & others, p.299</ref><ref name="url_The_Genetic_Codes_NCBI">{{cite web | url = http://www.ncbi.nlm.nih.gov/Taxonomy/Utils/wprintgc.cgi?mode=c | title = The Genetic Codes | author = Elzanowski A, Ostell J | authorlink = | author2 = | date = 7 April 2008 | work = | publisher = National Center for Biotechnology Information (NCBI) | pages = | quote = | accessdate = 10 March 2010 }}</ref> Ang mga kombinasyong Codon–[[transfer RNA|tRNA]] na hindi matatagpuan sa kalikasan ay maaari ring gamitin upang [[Expanded genetic code|palawakin ang kodigong henetiko]] at lumikha ng mga bagong protina na kilala bilang mga [[alloprotein]] na nagsasama ng mga hindi- proteinogenic na mga asidong amino.<ref name="pmid16260173">{{cite journal | author = Xie J, Schultz PG | title = Adding amino acids to the genetic repertoire | journal = Curr Opin Chem Biol | volume = 9 | issue = 6 | pages = 548–54 | year = 2005 | month = December | pmid = 16260173 | doi = 10.1016/j.cbpa.2005.10.011 }}</ref><ref name="pmid19318213">{{cite journal | author = Wang Q, Parrish AR, Wang L | title = Expanding the genetic code for biological studies | journal = Chem. Biol. | volume = 16 | issue = 3 | pages = 323–36 | year = 2009 | month = March | pmid = 19318213 | doi = 10.1016/j.chembiol.2009.03.001 | pmc = 2696486 }}</ref><ref name="isbn0-387-22046-1">{{cite book | author = Simon M | title = Emergent computation: emphasizing bioinformatics | publisher = AIP Press/Springer Science+Business Media | location = New York | year = 2005 | pages = 105–106 | isbn = 0-387-22046-1 }}</ref> |
||
==Mga sanggunian== |
==Mga sanggunian== |
||
Pagbabago noong 04:44, 17 Agosto 2019
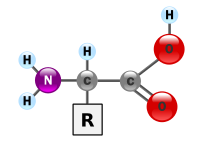
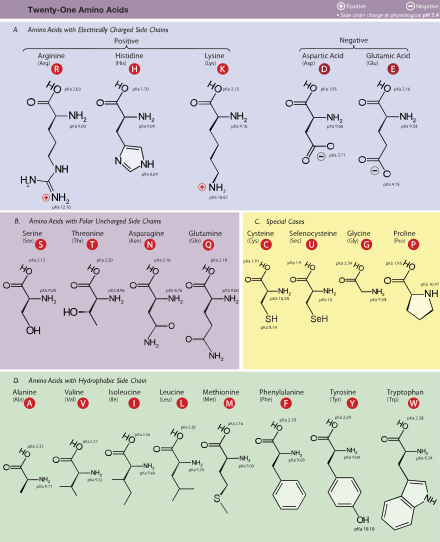
Ang mga asidong amino[1] o amino acid ang mga kompuwestong organiko na mahalaga sa biyolohiya na gawa mula sa mga functional group na amine (-NH2) at carboxylic acid (-COOH) kasama ng isang kadenang gilid na spesipiko sa bawat asidong amino. Ang mga mahahalagang elemento ng asidong amino ang carbon, hidroheno, oksiheno, at nitroheno bagaman ang ilang mga elemento ay matatagpuan sa mga kadenang gilid ng ilang mga asidong amino. Ang mga 500 asidong amino ay alam [2] at mauuri sa maraming mga paraan. Sa istruktura, sila ay mauuri ayon sa mga lokasyon ng mga functional group bilang mga asidong amino na alpha- (α-), beta- (β-), gamma- (γ-) or delta- (δ-). Ang ibang mga kategorya ay nauugnay sa polaridad na kimikal, lebel ng pH at uri ng pangkat na kadenang gilid (aliphatic, asikliko, aromatiko, naglalaman ng hydroxyl o sulfur, etc.) Sa anyo ng mga protina, ang mga asidong amino ay bumubuo pinakamalaking sangkap (pagkatapos ng tubig) ng mga muscle, mga selula at mga tisyu ng tao.[3] Ang mga asidong amino na nag-aangkin ng parehong mga pangkat na amine at asidong carboxylic na nakakabit sa atomong una (alpha-) carbon ay may partikular na kahalagahan sa biyokimika. Ang mga ito ay kilala bilang 2-, alpha-, o α-amino acid (henerikong pormula H2NCHRCOOH in most cases[4] kung saan ang R ay isang organikong substituent na kilala bilang "side-chain");[5]. Kadalasan, ang katagang "asidong amino" ay ginagamit upang spesipikong tumukoy sa mga ito. Ito ay kinabibilangan ng mga 23 proteinogenic ("nagtatayo ng protina") asidong amino na naghahalo tungo sa mga kadenang peptide ("polypeptides") upang bumuo ng mga pantayong bloke ng isang malaking bilang ng mga protina.[6] Ang lahat ng ito ay mga L-stereoisomer ("kaliwang panig" na mga isomer) bagaman ang ilang mga D-amino acid ("kanang panig") ay nangyayari sa mga envelope ng bakterya at ilang mga antibiyotiko.[7][8] Ang 20 sa 23 asidong amino na proteinogenic ay tuwirang kinokodigo ng mga triplet codon sa kodigong henetiko at kilala bilang mga pamantayang asidong amino. Ang ibang tatlo(na hindi pamantayan o hindi kanonikal) ay pyrrolysine (na matatagpuan sa mga organismong metanohenikoat ibang mga eukaryote), selenocysteine (na umiiral sa maraming mga hindi eukaryote gayundin sa karamihan ng mga eukaryote), atN-Formylmethionine. Halimbawa, ang 25 na protinang pantao ay kinabibilangan ng selenocysteine (Sec) sa kanilang pangunahing istruktura,[9] at ang mga inilalarawan sa istrukturang mga enzyme (selenoenzyme) ay gumagamit ng Sec bilang katalitikong moiety sa kanilang mga aktibong lugar.[10] Ang Pyrrolysine at selenocysteine ay kinokodigo sa pamamagitan ng mga bersiyong codon. Halimbawa, ang selenocysteine ay kinokodigo ng stop codon at elementong SECIS.[11][12][13] Ang mga kombinasyong Codon–tRNA na hindi matatagpuan sa kalikasan ay maaari ring gamitin upang palawakin ang kodigong henetiko at lumikha ng mga bagong protina na kilala bilang mga alloprotein na nagsasama ng mga hindi- proteinogenic na mga asidong amino.[14][15][16]
Mga sanggunian
- ↑ "Tagalog Glossary: A" (PDF). Multilingual Glossary, Middle School Glossary, Science. Glencoe/McGraw-Hill. Nakuha noong 2013-11-11.
- ↑ Wagner, Ingrid; Musso, Hans (1983). "New Naturally Occurring Amino Acids". Angew. Chem. Int. Ed. Engl. 22 (22): 816–828. doi:10.1002/anie.198308161.
{{cite journal}}: Unknown parameter|month=ignored (tulong) - ↑ Human nutrition in the developing world – United Nations Food and Agriculture Organization, ch.8
- ↑ Proline is an exception to this general formula. It lacks the NH2 group because of the cyclization of the side-chain and is known as an imino acid; it falls under the category of special structured amino acids.
- ↑ – INTRODUCING AMINO ACIDS
- ↑ "The Structures of Life". National Institute of General Medical Sciences. Nakuha noong 20 May 2008.
- ↑ "Biochemical pathways: an atlas of biochemistry and molecular biology" – Michal, p.5
- ↑ "Biochemistry I: Amino Acids". Cliffsnotes.com. Nakuha noong 9 November 2012.
- ↑ Kryukov GV, Castellano S, Novoselov SV, Lobanov AV, Zehtab O, Guigo R, et al. Characterization of mammalian selenoproteomes. Science. 2003;300:1439–1443.
- ↑ Gromer, S., Urig, S., Becker, K. (2004) The Thioredoxin System - From Science to Clinic. Medicinal Research Reviews. 24(1):40-89.
- ↑ Modeling Electrostatic Contributions to Protein Folding and Binding – Tjong, p.1 footnote
- ↑ Frontiers in Drug Design and Discovery ed. Atta-Ur-Rahman & others, p.299
- ↑ Elzanowski A, Ostell J (7 April 2008). "The Genetic Codes". National Center for Biotechnology Information (NCBI). Nakuha noong 10 March 2010.
- ↑ Xie J, Schultz PG (2005). "Adding amino acids to the genetic repertoire". Curr Opin Chem Biol. 9 (6): 548–54. doi:10.1016/j.cbpa.2005.10.011. PMID 16260173.
{{cite journal}}: Unknown parameter|month=ignored (tulong) - ↑ Wang Q, Parrish AR, Wang L (2009). "Expanding the genetic code for biological studies". Chem. Biol. 16 (3): 323–36. doi:10.1016/j.chembiol.2009.03.001. PMC 2696486. PMID 19318213.
{{cite journal}}: Unknown parameter|month=ignored (tulong)CS1 maint: multiple names: mga may-akda (link) - ↑ Simon M (2005). Emergent computation: emphasizing bioinformatics. New York: AIP Press/Springer Science+Business Media. pp. 105–106. ISBN 0-387-22046-1.
