Termodinamika
Tulungang mapabuti po ito sa pamamagitan ng pagdagdag ng mga pagsipi sa mga sangguniang mapagkakatiwalaan. Tandaan lamang po na maaari pong mapagdudahan at matanggal ang mga hindi beripikadong nilalaman. |
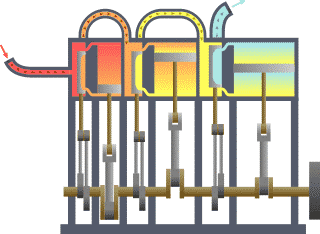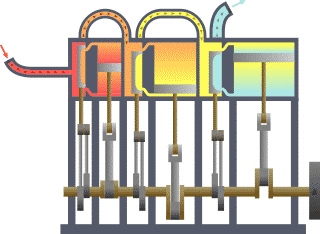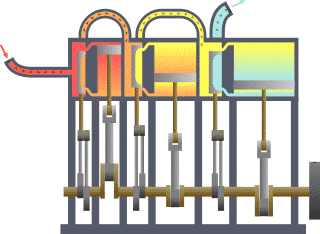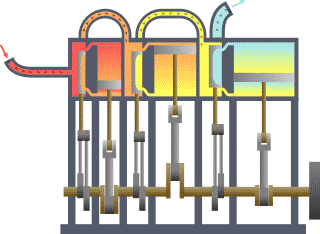
Ang termodinamika (mula sa Griyegong thermos, init, at dunamis, kapangyarihan; lakas) o initsigan ay sanga ng pisika na nag-aaral sa epekto ng pagbabago sa temperatura, presyon, at buok (volume) sa mga sistemang pisikal sa sukat makroskopyo sa pagsusuri ng kolektibong (o pinagsamang) kilos ng kanilang ng mga partikula sa pamamagitan ng estadistika. Sa madaling salita, ang init ay “enerhiyang gumagalaw” at ang dinamika ay tumutukoy sa “paggalaw” nito, kaya sinasabi na ang termodinamika ay nag-aaral sa paggalaw ng enerhiya at kung papaano nakapagpapagalaw ang enerhiya. Noong una, umunlad ang termodinamika dahil sa pangangailangang mapainam ang takbo ng mga unang makinang gumagamit ng kulong singaw ng tubig (mga makinang pinasisingawan).
Pananaw[baguhin | baguhin ang wikitext]
Ang unang tinatalakay sa pag-aaral ng termodinamika ay ng mga batas nito na naglilinaw na ang enerhiya ay mapagpapalit sa pagitan ng mga sistemang pisikal bilang init o gawa. Naglilinaw din ito sa pag-inog ng kantidad na tinatawag na entropiya na maitatakda sa anumang sistema. Sa termodinamika, ang pagniniig ng malalaking kalipunan ng bagay ay mapag-aaralan at maisasaayos. Sentral dito ang konsepto ng ‘sistema’ at ‘paligid’. Ang isang ‘sistema’ ay binubuo ng mga partikula na kung saan ang karaniwang galaw nito ay itinatakda ng kanilang katangian at kung saan naman ito ay may relasyon sa bawat isa sa pamamagitan ng mga ekwasyon ng estado. Mapagsasama ang mga katangian nila upang ipakita ang enerhiyang panloob at termodinamikong potensiyales na mahalaga upang alamin ang mga kondisyones para ekilibrio (panatag) at tuloy-tuloy ang mga proseso (spontaneous processes) nito.
Sa mga kasangkapang ito, maipaliliwanag ng termodinamika kung papaano sumasagot ang mga sistema sa pagbabago sa kanilang paligid. Magagamit ito sa maraming paksa sa agham at inhenyeriya tulad ng makinarya, transisyon sa pase, reaksiyong kimikal, kababalaghan sa pahatiran at kahit na sa mga black holes sa kalawakan. Mahalaga rin ang mga resulta sa termodinamika sa ibang larangan ng pisika, kimika, inhenyeriyang kimikal, biyolohiyang pangselula, inhenyeriyang pangbiyomedikal at agham ng materyales.
Klasikong termodinamika[baguhin | baguhin ang wikitext]

Ang klasikong termodinamika ang unang pag-aaral ng termodinamika na nakatutok sa mga termodinamikong katayuan at katangian tulad ng enerhiya, gawa at init, at sa mga batas ng termodinamika na salat sa atomikong interprestasyon. Sa panimulaing porma, hinalaw ang klasikong termodinamika mula sa postulado noong 1662 ng pisikong si Robert Boyle na ang presyong P ng isang kantidad ng gas ay kasalungat sa buok (volume) nitong V sa konstant na temperatura; kaya sa pormang ekwasyon nito: ang PV = k ay isang konstant. Dito nagsimula umunlad ang agham ng init nang matagumpay na makagawa ng isang makinang pinatatakbo ng kulong singaw ng tubig sa Inglaterra ni Thomas Savery noon 1697 at Thomas Newcomen noong 1712. Halos magkasabay lumitaw ang una at ikalawang batas ng termodinamika noong mga 1850 sa pangunguna ng mga saliksik nina William Rankine, Rudolf Clausius, at William Thomson (Lord Kelvin).
Pang-estadistikang termodinamika[baguhin | baguhin ang wikitext]
Sa pag-unlad ng mga hinuang pang-atomika at pang-molekula noong dakong huli ng siglo 19, binigyan ng kahulugang pang-molekula ang termodinamika. Ang larangang ito ay tinawag na pang-estadistikang termodinamika na masasabing tulay sa mga katangiang makroskopyo at mikroskopyo ng mga sistema. Sa katunayan, ang pang-estadistikang termodinamika ay isang landas sa termodinamika na nakasadlak sa pang-mekanikang estadistika na kung saan nakatutok sa paghahalaw ng mga makroskopyong resulta mula sa mga unang prinsipyo. Maihaharap ito sa makasaysayang pinanggalingan nito na kabalaghaang termodinamikang nagbibigay ng maka-agham na paliwanag sa mga kabalaghaan na umiiwas sa mga mikroskopyong detalye. Hinalaw ang lahat ng makroskopyong katangian (temperatura, buok, presyon, enerhiya, entropiya, etc) mula sa estadistikong paraan ng mga gumagalaw ng partikulang sangkap at mga pagniniig nila sa bawat isa (kasama ang kwantikong kabalaghaan). Nasumpungang matagumpay ito at kaya karaniwang nang ginagamit ito.
Pang-kimikang termodinamika[baguhin | baguhin ang wikitext]
Ang pangkimikang termodinamika ay pag-aaral sa pagkakaugnay ng init sa pagsasanib kimikal o sa pagbabagong pisikal ng estado ng mga kimikal sa loob na saklaw ng mga batas ng termodinamika. Noong mga taon ng 1873-76 naglathala si Willard Gibbs, matematikong pisikong Amerikano, ng isang serye ng tatlong papel na kung saan pinakasikat dito ang On the Equilibrium of Heterogeneous Substances, kung saan kanyang ipinakita kung papaano grapikong masusuri ang mga termodinamikong proseso sa pamamagitan ng pag-aaral ng enerhiya, entropiya, buok, temperatura at presyon ng termodinamikong sistema sa paraan upang alamin kung ang isang proseso ay tuluyang mangyayari. Noong bungad ng siglo 20, ang mga kimikong tulad nina Gilbert Lewis, Merle Randall, at E. A. Guggenheim ay nagsimulang gumamit ng mga matematikong paraan ni Gibbs sa pagsusuri ng mga prosesong kimikal.
Mga termodinamikong instrumento[baguhin | baguhin ang wikitext]
May dalawang uri ng termodinamikong instrumento – ang metro (panukat) at ang imbakan (reservoir). Ang isang termodinamikong panukat ay anumang instrumento na sumusukat sa isang termodinamikong sistema. Sa ilang kaso, ang termodinamikong susukatin ay itinatakda ayon sa idealized na instrumentong panukat. Halimbawa, isinasaad sa batas zeroth na kapag ang dalawang katawan ay nasa ekilibriong termal sa ikatlong katawan, ang dalawang ito ay nasa ekilibriong termal sa isa’t-isa. Ang prisipyong ito, puna ni James Maxwell noong 1872, ang nangingibabaw na maaring sukatin ang temperatura. Ang idealized thermometer ay isang halimbawa ng isang ideal na gas na may konstant na presyon. Mula sa batas ng ideal gas PV=nRT, ang buok ng isang sampol ay magagamit na pahiwatig ng temperatura; sa paraang ito itinatakda ang temperatura. Alalaumbaga, ang presyon ay mekanikong itinatakda, makagagawa rin ng isang instrumentong panukat na tinatawag na barometro mula sa isang sampol in isang ideal gas na nakatinag sa konstant na temperatura. Ang kalorimetro ang instrumentong ginagamit upang sukatin at itakda ang panloob na enerhiya ng isang sistema.
Ang isang termodinamikong imbakan ay isang napakalaking sistema na hindi magbabago ng mga parametrong estado nito kahit idikit sa sistemang pinag-aaralan. Ginagamit ito upang magbigay ng isang partikular na halaga ng isang parametrong estado sa isang sistema. Halimbawa, ang isang imbakan ng presyon ay isang sistemang nasa partikular na presyon na nagbibigay ng presyon sa anumang sistemang pinag-aaralan na mekanikong nakarugtong dito. Ang himpapawid ng lupa natin ay karaniwang ginagamit bilang imbakan ng presyon.
Mahalagang linawin ang dalawang uri ng intrumentong ito. Hindi natatatrahaho ng tama ang isang metro kapag ito kumikilos na parang imbakan ng susukating kalagayan ng estado. Halimbawa, ang isang termometro na kapag ito ay gumaganap na imbakan ng temperatura, babaguhin nito ang temperatura ng sistemang sinusukat at magbibigay ito ng maling sukat. Ang mga ideal na panukat ay walang epekto sa mga kondisyones ng sistemang sinusukat.
Mga estado sa termodinamika[baguhin | baguhin ang wikitext]
Sinasabing ang sistema ay nasa tiyak na estado kapag nasa ekilibrio ito sa ilalim ng isang set na mga kondisyones. Ang estado ng sistema ay maipaliliwanag sa paggamit ng mga baryabol na intensibo (pangpakitid) at ekstensibo (pangmalawak). Maipaliliwanag ang mga katangian ng sistema sa paggamit ng ekwasyon ng estado na nagtatakda sa relasyon sa pagitan ng mga baryabol na ito. Ang estado ay maaring isipin bilang isang saglit at tiyak na paliwanag sa isang sistema na gumagamit ng isang konstant na set na bilang ng baryabol.
Ang mga termodinamikong sistema[baguhin | baguhin ang wikitext]
Ang isang mahalagang konsepto sa termodinamika ay ang “sistema”. Ang anumang rehiyon sa sanlibutan na pinag-aaralan ay tinatawag na sistema. Inihihiwalay ang sistema sa labas ng sanlibutan ng isang hanggahan na maaring tunay o hindi, at kung saan nagtatapos ang dami nito. Ang posibleng pagpapalitan ng gawa, init o materya sa pagitan at paligid nito ay nagaganap sa hanggahang ito. May limang nangungunang klase ng sistema:
1. Sistemang Nakahiwalay (Isolated Systems) – ang materya at enerhiya ay hindi makatatawid sa hanggahan.
2. Sistemang Adiabatiko (Adiabatic Systems) – ang init ay hindi makatatawid sa hanggahan.
3. Sistemang diatermiko (Diathermic Systems) – makatatawid ang init sa hanggahan.
4. Sistemang nakpinid (Closed Systems) – ang materya ay hindi makatatawid sa hanggahan.
5. Sistemang nakabukas (Open Systems) – makatatawid ang init, gawa, at materya sa hanggahan.
Sa paglakad ng panahon, nagpapantay ang mga panloob na pagkakaiba ng mga sistemang nakahiwalay; nagkakapantay ang mga presyon at temperature gayundin ang pagkakaiba sa densidad. Tinatawag na nasa estado ng termodinamikong ekilibrio (kapanatagan) ang isang sistema kapag naganap nang lubos ang pagkakapantay ng proseso sa loob nito.
Sa pagtatakda ng termodinamikong ekilibrio, ang mga katangian ng isang sistema ay hindi magbabago sa paglakad ng panahon. Mas simple at madaling maunawaan ang mga sistemang nasa ekilibrio kaysa hindi nasa ekilibrio. Kadalasan, sa pagsusuri ng isang termodinamikong proseso, ipinapalagay na ang bawat intermedyong estado sa loob ng proseso ay nasa ekilibrio. Magpapasimple ito sa situwasyon. Ang mga termodinamikong proseso na napakabagal umusad upang ang intermedyong hakbanging ay magkaroon ng estadong nasa ekilibrio ay sinasabing mga baliktaring proseso.
Mga panukatan (parameters) sa termodinamika[baguhin | baguhin ang wikitext]
Ang pinakabuod ng konsepto ng termodinamika ay ang enerhiya at abilidad nitong makagawa ng trabaho. Ang kabuuang enerhiya ng sistema at paligid nito ay pinananitili na isinasaad ng unang batas. Maari ito ilipat o isalin sa ibang katawan sa pamamagitan ng pag-iinit, kompresyon o pagdaragdag ng materya, at makukuha naman ito sa isang katawan sa pamamagitan ng pagpapalamig, pagpapalaki o pag-aalis ng materya. Sa paghahambing sa mekanika, ang paglilipat ng enerhiya ay bunga ng pwersang nagdulot ng pag-alis nito. Sa katulad na paraan, maipapalagay ang termodinamikong sistema bilang paglilipat ng enerhiya bunga ng isang malawak na pwersa na nagdulot ng pag-usad na kung saan ang produkto ng dalawa ay katumbas ng inilipant na enerhiya. Ang pares na ito ng termodinamikong pwersa-pagpapalit ay tinatawag na mga magkakambal na baryabol. Ang pinakakaraniwang magkakambal na termodinamikong baryabol ay ang presyon- buok (mekanikong panukatan), temperatura-entropiya (panukatan sa init), at kimikong potensiyal-bilang ng partikula (panukatang materyal)
Mga batas ng termodinamika[baguhin | baguhin ang wikitext]
May apat na batas sa termodinamika na tama sa maraming aplikasyon at dahil dito hindi umaasa sa detalye ng pagniniig o sa sistemang pinag-aaralan. Magagamit ito sa mga sistemang wala tayong kaalam-alam maliban sa balanse ng enerhiya at materyang inilipat. Halimbawa rito ang hula ni Einstein sa agarang pagsingaw nitong pagdating ng siglo 20 at kasalukuyang pananaliksik sa termodinamika ng black holes.
Ito ang apat na batas:
• Batas Zeroth ng termodinamika na nagsasaad na ang ekilibriong termodinamiko ay may katumbas na relasyon. Kung ang dalawang termodinamikong sistema ay nasa ekilibriong termal sa ikatlo, lahat sila ay nasa ekilibriong termal sa isa’t-isa.
• Unang batas ng termodinamika na tungkol sa pananatili ng enerhiya. Ang pagtaas sa enerhiya ng isang saradong sistema ay katumbas ng dami ng enerhiyang idinagdag sa sistema sa pag-init nito pwera ang nawalang dami bilang gawa ng sistema sa paligid nito.
• Ikalawang batas ng termodinamika na tungkol sa entropiya. Ang kabuuang entropiya ng isang hiwalay ng termodinamikong sistema ay tumataas sa paglakad ng panahon hanggang marating nito ang kataas-taasang halaga.
• Ikatlong batas ng termodinamika na tungkol sa absolutong serong termperatura. Kapag naabot ng isang sistema ang absolutong serong temperatura, ang lahat ng proseso ay titigil at ang entropiya ng sistema ay aabot sa pinakamababang halaga nito.
Malinaw na isinasaad ang batas ng paganito: “ang entropiya ng isang perpektong katawang kristalino sa temperaturang absolute zero ay zero.”
Mga termodinamikong potensiyales[baguhin | baguhin ang wikitext]
Mahahalaw mula sa mga ekwasyon sa pagtutumbas ng enerhiya sa isang termodinamikong sistema ang pagtutuos ng enerhiya na tinatawag na termodinamikong potensiyales. Ito ang pagsukat sa nakatagong enerhiya ng isang sistema. May apat na bantog na potensiyales: Enerhiyang panloob (Internal energy)
| Enerhiyang panloob | |
| Malayang enerhiyang Helmholtz (Helmholtz free energy) | |
| Entalpiya (Enthalpy) | |
| Malayang enerhiyang Gibbs (Gibbs free energy) |
Ginagamit ang mga potensiyales upang sukatin ang pagbabago sa enerhiya sa mga sistema habang sila’y umiinog sa simulang estado hanggang huling estado. Ang potensiyal na gagamitin ay depende sa mga constraints ng sistema tulad ng di-nagbabagong temperatura o presyon. Ang panloob na enerhiya ay ang panloob na enerhiya ng sistema, ang entalpiya ay panloob na enerhiya at enerhiyang gawa mula sa presyon-volume, ang malayang enerhiyang Helmholtz at Gibbs ay mga enerhiyang magagamit ng sistem upang makagawa ng isang nakatutulong na trabaho kapag ang temperatura at buok, o ang presyon at temperature ay hindi magbabago, sa magkasunod na nabanggit.




