Carbon dioxide
 | |||
| |||
| Mga pangalan | |||
|---|---|---|---|
| Mga ibang pangalan
Carbonic acid gas
Carbonic anhydride Carbonic oxide Carbon oxide Carbon(IV) oxide Dry ice (solid phase) | |||
| Mga pangkilala | |||
Modelong 3D (JSmol)
|
|||
| 3DMet | |||
Reperensya sa Beilstein
|
1900390 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Infocard ng ECHA | 100.004.271 | ||
| Bilang ng EC |
| ||
| Bilang ng E | E290 (mga pampreserba) | ||
Reperensya sa Gmelin
|
989 | ||
| KEGG | |||
| MeSH | Carbon+dioxide | ||
PubChem CID
|
|||
| Bilang ng RTECS |
| ||
| UNII | |||
| Bilang ng UN | 1013 | ||
Dashboard ng CompTox (EPA)
|
|||
| |||
| |||
| Mga pag-aaring katangian | |||
| CO2 | |||
| Bigat ng molar | 44.01 g·mol−1 | ||
| Hitsura | Colorless gas | ||
| Amoy | Odorless | ||
| Densidad | 1562 kg/m3 (solid at 1 atm and −78.5 °C) 770 kg/m3 (liquid at 56 atm and 20 °C) 1.977 kg/m3 (gas at 1 atm and 0 °C) | ||
| Puntong natutunaw | −78.5 °C; −109.2 °F; 194.7 K | ||
| Puntong kumukulo | −56.6 °C; −69.8 °F; 216.6 K | ||
Solubilidad sa tubig
|
1.45 g/L at 25 °C, 100 kPa | ||
| Pagkaasido (pKa) | 6.35, 10.33 | ||
Repraktibong indeks (nD)
|
1.1120 | ||
| Biskosidad | 0.07 cP at −78.5 °C | ||
Momento ng dipolo
|
zero | ||
| Istraktura | |||
| linear | |||
| Termokimika | |||
Pamantayang entropiyang
molar (S⦵298) |
214 J·mol−1·K−1 | ||
Pamantayang entalpya
ng pagbuo (ΔfH⦵298) |
−393.5 kJ·mol−1 | ||
| Mga panganib | |||
| NFPA 704 (diyamanteng sunog) | |||
| Mga kompuwestong kaugnay | |||
Ibang mga anion
|
Carbon disulfide Carbon diselenide | ||
Ibang mga cation
|
Silicon dioxide Germanium dioxide Tin dioxide Lead dioxide | ||
Maliban kung saan nabanggit, binigay ang datos para sa mga materyales sa kanilang estadong pamantayan (sa 25 °C [77 °F], 100 kPa).
| |||
Ang dioksido de karbono ay isang kompuwestong kimikal na binubuo ng dalawang mga atomong oksiheno na kobalenteng nakakawing isang atomong karbono. Ang pormulang kimikal ng carbon dioxide ay CO2.
Bilang bahagi ng siklong karbono, ang mga halaman, algae at mga cyanobakterya ay gumagamit ng enerhiyang liwanag upang magpotosintesis ng karbohidrata mula sa dioksidong karbono at tubig na lumilikha ng oksiheno bilang isang tinatapong produkto.[1] Gayunpaman, ang potosintesis ay hindi maaaring mangyari sa kadiliman at sa gabi, ang ilang dioksidong karbono ay nalilikha ng mga halaman tuwing respirasyon ng selula.[2] Ang dioksidong karbono ay nalilikha sa pamamagitan ng kombustiyon ng coal o hidrokarbono, permentasyon ng mga asukal sa serbesea at paggawa ng wine at sa pamamagtian ng respirasyon ng lahat ng mga organismong nabubuhay. Ito ay inilalabas sa hininga ng mga tao at hayop na panglupain. Ito ay nilalabas sa mga bulkan, mga maiinit na batis, mga geyse at ibang mga lugar kung saan ang kortesa ng mundo ay manipis at pinapalaya mula sa mga abtong karbonata sa pamamagitan ng disolusyon. Ang CO2 May malaking interes sa mga epektong pangkapaligiran ng dioksidong karbono. Ito ay isang mahalaang gaas na greenhouse na nag-iinit ng ibabaw ng mundo sa mataas na temperatura sa pamamagitan ng pagbabawas ng panlabas na radyasyon. Ang pagsusunog ng mga nakabase sa karbonong panggatong simula ng himagsikang industriyal ay mabilis na nagpataas ng mga konsentrasyon ng dioksidong karbono sa atmospero na nagpapataas ng rate ng pag-iinit na pang-globo at pagsasanhi ng antropohenikong pagbabago sa klima. Ito rin ang pangunahing pinagmumulan ng asidipikasyon sa karagatan dahil tinutunaw nito ang tubig upang bumuo ng asidong karboniko na isang mahinang asido dahil sa ang ionisasyon nito sa tubig ay hindi kumpleto.
- CO2 + H2O
 H2CO3
H2CO3
Mga katangiang kimikal at pisikal
[baguhin | baguhin ang wikitext]Istruktura at pagkakawing
[baguhin | baguhin ang wikitext]Ang molekulang dioksidong karbono ay linyar at sentrosimetiko. Ang dalawang mga kawing na C-O ay magkatumbas at maiksi (116.3 pm) na umaayon sa dobleng pagkakawing.[3] Dahil ito ay sentrosimetiko, ang molekula ay walang dipolong elektrikal. Umaayon sa katotohanan ito, ang tanging dalawang mga bandang bibrasyonal ay napagmamasdan sa IR spectrum – isang modong paghahatak na antisimetriko sa 2349 cm−1 at isang malilikong modo malapit sa 666 cm−1. May isa ring simetrikong modong paghahatak sa 1388 cm−1 na mapagmamasdan lamang sa spektrum na Raman.
Sa solusyong matubig
[baguhin | baguhin ang wikitext]Ang dioksidong karbono ay soluble sa tubig kung saan baliktad na mababago sa H2CO3 (asidong karboniko).
Ang konstanteng ekwilibriyum na hidrasyon ng asidong karboniko ay (sa 25 °C). Kaya ang karamihan ng dioksidong karbono ay hindi nababago sa asidong karboniko ngunit nananatili bilang mga molekulang CO2 na hindi umaapekto sa pH. Ang mga relatibong konsentrasyon ng CO2, H2CO3 at mga anyong deprotonatadong HCO−3 (bikarbonate) at CO2−3(karbonata) ay nakasalalay sa pH. Gaya ng ipinapakita sa Bjerrum plot, sa neutral o katamtamang tubig na alkalino (pH > 6.5), ang anyong bikarbonata ay nananaig (>50%) at nagiging pinakanananaig (>95%) sa pH ng tubig dagat. Sa napaka alkalinong tubig (pH > 10.4) ang anyong nananaig (>50%) ay karbonata. An gmga karagatan na katamtamang alkalino na may tipikal na pH = 8.2–8.5 ay naglalaman ng mga 120 mg ng bikarbonata kada litro. Sa pagiging diprotiko, ang asidong karboniko ay may dalawang mga konstanteng disosiasyong asido na ang una ay para sa disosiasyon tungo sa ionong bikarbonata(na tinatawag ring karbonatang hidroheno (HCO3−):
- H2CO3
 HCO3− + H+
HCO3− + H+ - Ka1 = 2.5×10−4 mol/L; pKa1 = 3.6 at 25 °C.[3]
Ito ang tunay na asidong konstanteng disosiasyon na inilalarawan bilang kung saan ang denominador ay kinabibilangan lamang na kobalenteng nakakawing na H2CO3 at hindi nagsasama ng hydradong CO2(aq). Ang higit na mas maliit at kadalasang sinisiping halaga malapit sa 4.16×10−7 ay isang maliwanag na halagang kinakalkula sa hindi tamang pagpapalagay na ang lahat ng natunaw na CO2 ay umiiral bilang asidong karbonik upang ang . Dahil ang karamihan ng mga natutunaw na CO2 ay nananatili bilang mga molekulang CO2, ang Ka1ay may mas malaking denominador at isang higit na mas maliit na halaga kesa sa tunayna Ka1.[4]
Ang ionong bikarbonata ay isang espesyeng atmospero na maaaring umasal bilang isang asido o isang base depende sa pH ng solusyon. Sa mataas na pH, ito ay malaking naghihiwalay sa ionong karbonata (CO32−):
- HCO3−
 CO32− + H+
CO32− + H+ - Ka2 = 4.69×10−11 mol/L; pKa2 = 10.329
Sa mga organismo, ang produksiyon ng asidong karbonisa ay kinakatalisa ng ensaym na anhidraseng karboniko.
Mga reaksiyong kimikal ng CO2
[baguhin | baguhin ang wikitext]Ang CO2 ay isang mahinang elektropila. Ang reaksiyon nito sa tubig ay nagpapakita ng katangiang ito kung saan ang hidroksido ang nukleopila. Ang ibang mga nukleyopila ay may reaksiyon rin. Halimbawa, ang mga karbanion na ibininigay ng mga reahenteng Grignard at mga kompuwestong organolitiyum ay may reaksiyon sa CO2 upang magbigay ng mga karboksilata:
Sa mga kompleks na metal na dioksidong karbono, ang CO2 ay nagsisilbi bilang isang ligando na maaaring magpadali sa pagbabago ng CO2 sa ibang mga kemikal.[5]
Ang pagpapaliit ng CO2 tungo sa CO ay ordinaryong mahirap at mabagal na reaksiyon:
- CO2 + 2 e− + 2H+ → CO + H2O
Ang redoksong potensiyal para sa reaksiyong ito malapit sa pH 7 ay mga −0.53 V laban sa pamantayang elektrodong hidroheno. Ang ensaym na naglalaman ng nikel na dehidrohenaseng monoksidong karbono ay nagkakatalisa ng prosesong ito.[6]
Mga katangiang pisikal
[baguhin | baguhin ang wikitext]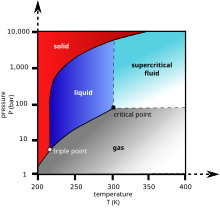
.

Ang dioksidong karbono ay walang kulay. Sa mga mababang konsentrasyon, ang gaas ay walang amoy. Sa mas mataas na mga konsentrasyon, ito ay may matalas na amoy na asidiko. Sa pamantayang temperatura at presyon, ang densidad ng dioksidong karbono ay mga 1.98 kg/m3 na mga 1.5 beses ng hangin. Ang dioksdiong karbono ay walang estadogn likido sa mga presyon na mababa sa 5.1 standard atmosphere (520 kPa). sa 1 atmopsero malapit sa presyon ng lebel ng dagat, ang mga gaas ay direkta nadedeposito sa isang solido sa mga temperaturang mababa −78.5 °C (−109.3 °F; 194.7 K) at sa solidong ay direktang nagsusublima sa isang gaas na mataas sa −78.5 °C. Sa estadong solido nito, ang dioksidong karbono ay karaniwang tinatawag na tuyong yelo. Ang likidong dioksidong karbono ay nabubuo lamang sa mga presyon na mas mataas sa 5.1 atm; ang tripleng punto ng dioksidong karbono ay mga 518 kPasa −56.6 °C. Ang puntong kritikal ay 7.38 MPa sa 31.1 °C.[7] Ang isa pang anyo ng solidong dioksidong karbono na napapagmasdan sa mataas na presyon ay isang amorposong tulad ng salaming solido.[8] Ang anyong ito ng salamit na tinatawag na carbonia ay nalilikha ng sobrang paglalamig ng pinainit na CO2 sa sukdulang presyon (40–48 GPa o 400,000 atmospero) sa isang diyamanteng anbil. Ang pagkakatuklas na ito ay nagpapautnay ng teoriya na ang dioksidong karbono ay maaaring umiral sa isang estadong salamit katulad ng ibang mga kasapi ng pamilyang pang-elemento nito tulad ng silikon(silica glass) at dioksidong hermaniyum. Hindi tulad ng silica at mga salaming hermaniya, ang salaming carbonia ay hindi matatag sa mga normal na presyon at bumabalik sa gaas kapag ang presyon ay pinalaya.
Mga sanggunian
[baguhin | baguhin ang wikitext]- ↑ Donald G. Kaufman; Cecilia M. Franz (1996). Biosphere 2000: protecting our global environment. Kendall/Hunt Pub. Co. ISBN 978-0-7872-0460-0. Nakuha noong 11 Oktubre 2011.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Food Factories. www.legacyproject.org. Retrieved on 2011-10-10.
- ↑ 3.0 3.1 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (ika-2nd (na) edisyon). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Jolly, William L., Modern Inorganic Chemistry (McGraw-Hill 1984), p. 196
- ↑ M. Aresta (Ed.) "Carbon Dioxide as a Chemical Feedstock" 2010, Wiley-VCH: Weinheim. ISBN 978-3-527-32475-0
- ↑ Colin Finn, Sorcha Schnittger, Lesley J. Yellowlees, Jason B. Love "Molecular approaches to the electrochemical reduction of carbon dioxide" Chemical Communications 2011, 0000. doi:10.1039/c1cc15393e
- ↑ "Phase change data for Carbon dioxide". National Institute of Standards and Technology. Nakuha noong 2008-01-21.
{{cite web}}: CS1 maint: date auto-translated (link) - ↑ Santoro, M.; Gorelli, FA; Bini, R; Ruocco, G; Scandolo, S; Crichton, WA (2006). "Amorphous silica-like carbon dioxide". Nature. 441 (7095): 857–860. Bibcode:2006Natur.441..857S. doi:10.1038/nature04879. PMID 16778885.
{{cite journal}}: CS1 maint: date auto-translated (link)
![]() Ang lathalaing ito na tungkol sa Agham ay isang usbong. Makatutulong ka sa Wikipedia sa pagpapalawig nito.
Ang lathalaing ito na tungkol sa Agham ay isang usbong. Makatutulong ka sa Wikipedia sa pagpapalawig nito.
- Articles with changed Chembox image
- Chemical articles with multiple compound IDs
- Multiple chemicals in an infobox that need indexing
- Pages using Chembox with unknown parameters
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Mga kompuwestong kimikal




![{\displaystyle K_{\mathrm {h} }={\frac {\rm {[H_{2}CO_{3}]}}{\rm {[CO_{2}(aq)]}}}=1.70\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/880be9280cefa51b14dc80f037e4296c81a15e6b)
![{\displaystyle K_{a1}={\frac {\rm {[HCO_{3}^{-}][H^{+}]}}{\rm {[H_{2}CO_{3}]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81950791f8b36374241d6fa82828522bd875668a)
![{\displaystyle K_{\mathrm {a1} }{\rm {(apparent)}}={\frac {\rm {[HCO_{3}^{-}][H^{+}]}}{\rm {[H_{2}CO_{3}]+[CO_{2}(aq)]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4cac9482fd21cb58444f2621f245d7b1d835485)