Atomo: Pagkakaiba sa mga binago
m cite |
DerekWinters (usapan | ambag) No edit summary |
||
| Linya 2: | Linya 2: | ||
[[Talaksan:Atom.png|thumb|Atomong modelo ng [[Helium]] o [[Helio]].]] |
[[Talaksan:Atom.png|thumb|Atomong modelo ng [[Helium]] o [[Helio]].]] |
||
Sa kimika at pisika, ang '''atomo''' (Griyegong ἄτομος o ''atomos'' na may kahulugang "hindi mahahati"<ref name=WWT>{{cite-WWT|''Atoms'', Leucippus, ''Who First Thought of Atoms?'', ''Science and Technology''}}, pahina 43.</ref>) o '''mulapik''' |
Sa kimika at pisika, ang '''atomo''' (Griyegong ἄτομος o ''atomos'' na may kahulugang "hindi mahahati"<ref name=WWT>{{cite-WWT|''Atoms'', Leucippus, ''Who First Thought of Atoms?'', ''Science and Technology''}}, pahina 43.</ref>) o '''mulapik'''<ref> Maugnaying Talasalitaang Pang-agham Ingles-Pilipino, 1969. </ref> ay pinakamaliit na partikula na nagbibigay katangian sa isang elementong kimikal. |
||
Ang atomo ay binubuo ng isang siksik na [[nukleyo]] ng mga [[proton]] na may positibong karga at mga [[neutron]] na may neutral na karga, at nababalot ng isang mas malaking ulap [[dagisik]] (elektron) na may negatibong karga. Neutral ang isang atomo kapag ang bilang ng mga proton at dagisik ay pareho. Ang bilang ng proton ng isang atomo ang nagtatakda kung anong elemento ito habang ang bilang ng neutron nito ang nagtatakda sa [[isotopo]] o [[kahasi]] ng elemento. |
Ang atomo ay binubuo ng isang siksik na [[nukleyo]] ng mga [[proton]] na may positibong karga at mga [[neutron]] na may neutral na karga, at nababalot ng isang mas malaking ulap [[dagisik]] (elektron) na may negatibong karga. Neutral ang isang atomo kapag ang bilang ng mga proton at dagisik ay pareho. Ang bilang ng proton ng isang atomo ang nagtatakda kung anong elemento ito habang ang bilang ng neutron nito ang nagtatakda sa [[isotopo]] o [[kahasi]] ng elemento. |
||
Pagbabago noong 22:05, 28 Mayo 2014
Nangangailangan ang artikulo o seksiyon na ito ng pagwawasto sa balarila, estilo, pagkakaisa, tono o baybay. |
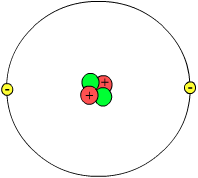
Sa kimika at pisika, ang atomo (Griyegong ἄτομος o atomos na may kahulugang "hindi mahahati"[1]) o mulapik[2] ay pinakamaliit na partikula na nagbibigay katangian sa isang elementong kimikal. Ang atomo ay binubuo ng isang siksik na nukleyo ng mga proton na may positibong karga at mga neutron na may neutral na karga, at nababalot ng isang mas malaking ulap dagisik (elektron) na may negatibong karga. Neutral ang isang atomo kapag ang bilang ng mga proton at dagisik ay pareho. Ang bilang ng proton ng isang atomo ang nagtatakda kung anong elemento ito habang ang bilang ng neutron nito ang nagtatakda sa isotopo o kahasi ng elemento.
Kasaysayan
Ang kaisipan kung saan ang materya ay binubuo ng tiyak na yunit na hindi na mahahati pa sa isang arbitraryong laki ay ipinalagay libong taon ang nakalilipas. Ang unang pagtalakay sa kaisipan ng atomo ay nagsimula sa matandang India noong ika-6 na siglo BCE. Pinaunlad ito sa paggamit ng masalimuot ng hinuha ng paaralang Nyaya at Vaisheshika kung paano nagsasanib ang mga atomo upang makabuo ng mga kumplikadong bagay (una pares-pares at pagkatapos tatluhan ng mga pares). Ang pagbanggit ng atomo sa kanluran ay lumitaw matapos ang isang daang taon mula kay Leucippus kung saan si Democritus na kanyang estudyante ang nag-ayos sa kanyang pananaw. Noong mga 450 BCE, ginamit ni Democritus ang katagang atomos, na ang ibig sabihin ay “di mahahati”. Kahit na ang kaisipang ito ay batay lamang sa pilosopiyang Indio at Griyego, nanatili ang paggamit nito sa makabagong agham.

Noong 1803, ginamit ni John Dalton ang konsepto ng atomo upang ipaliwanag bakit nagsasanib ang mga elemento na may simpleng proporsyon at kung bakit may ilang gas ang madaling matunaw sa tubig kaysa iba. Kanyang iminungkahi na ang bawat elemento ay binubuo ng atomo na may kanyang sariling kayarian at ito ay nakikipagsanib sa isa’t-isa upang makabuo ng kumpuwestong kimikal.
Noong 1827, si Robert Brown, isang Britanong dalubhalaman, ay gumamit ng isang mikroskopyo upang tingnan ang butil ng alikabok na nakalutang sa tubig. Tinawag niya ito “Brownian motion”. Nang lumaon, ipinakita ni Albert Einstein na ang paggalaw na ito ay dahil sa pagbabanggaan ng molekula ng tubig sa mga lutang na butil.
Noong 1897, natuklasan ng J.J. Thomson mula sa pag-aaral niya ang katodong rayos ang dagisik (elektron) at subatomikong kalikasan nito. Ito ang gumiba sa konsepto ng atomo na hindi na mahahati. Nang lumaon, natuklasan ni Thomson ang pag-inog ng mga isotopo mula sa trahaho niya sa mga ionisadong gas.
Paniwala ni Thomson na ang mga dagisik (elektron) ay nakakalat ng pantay-pantay sa buong atomo na tinitimbangan ng unipormeng lagom ng positibong karga. Subalit, noong 1909, sa pamamagitan ng eksperimento sa pohas ng ginto ni Ernest Rutherford ipinakikita na ang positibong karga ng isang atomo at halos buong bigat nito ay nakabunton sa nukleyo sa ubod ng atomo (modelong Rutherford) at kung saan ang mga dagisik ay lumilibot na parang planeta sa paligid ng araw. Noong 1913, idinagdag ni Niels Bohr ang mekaniks na kwantum sa modelong ito na nagsasaad na ang mga dagisik ay nakatira sa malinaw at tiyak na ligiran at kung saan makatatalon ito, at hindi ito malayang makabubulusok papasok o palabas sa mga intermedyong estado.
Noong 1926, mula sa mungkahi noong 1924 ni Louis DeBroglie, bumalangkas si Erwin Schrodinger ng isang matematikong modelo ng atomo na nagpapakita sa mga dagisik (elektron) bilang porma ng onda (waveform) na may tatlong dimensiyon hindi bilang partikulang tuldok. Ang kinahinatnan sa paggamit ng porma ng onda sa pagpapakita sa dagisik na ipinakita ni Werner Heisenberg matapos ang isang taon, na imposible sa matematika na tiyaking magkasabay ang posisyon at momento ng isang partikula sa isang saglit ng panahon; ito ang tinawag ng prinsipyo ng walang-katiyakan. Sa konseptong ito, sa anumang halaga ng posisyon nito, maaring alamin ang lawak ng posibleng halaga ng momento, at vice versa. Datapuwat mahirap isalarawan ito sa isip, naipaliwanag nito ang mga ugali ng atomo ng hind maipaliwanag ng naunang mga modelo tulad ng tiyak na padrong espektral at estruktural ng mga atomong mas malaki sa hidroheno. Dahil dito, ipinasantabi ang modelong planetaryo at tinanggap ang modelong ito kung saan maipaliliwanag ang sonang orbital sa palibot ng nukleyo kung saan matibay na maipapalagay naroon ang isang dagisik (elektron).
Mga subatomikong partikulo
Anupa’t, ang katagang atomo ay may kahulugang hindi mahahati sa higit na maliliit pang mga partikula.. Subalit sa modernong gamit, ang “atomo” ay binubuo ng iba’t-ibang subatomikong partikulo, katulad ng mga sumusunod:
- Ang dagisik (elektron), na may negatibong karga kung saan ang laki nito ay kasalukuyang hindi pa rin nasusukat; pinakamagaang ito sa tatlong elementaryong partikula at may bigat na 9.11x10−31kg.
- Ang proton, na may positibong karga, na may malayang bigat na higit 1836 ulit na mabigat kaysa dagisik (bigat na 1.67x10−27kg, alalaumbaga bumababa ito kung may kasangkot itong enerhiyang pangkawing (binding energy).)
- Ang neutron, na walang karga – neutral, na may malayang bigat na 1839 ulit na mas mabigat kaysa dagisik (elektron) at halos kapareho sa laki ng proton na may 2.5x10−15 m diametro, alalaumbaga ang “rabaw” ng isang proton o neutron ay hindi malinaw na maitatakda.
Ang proton at neutron ang bumubuo sa makapal at mabigat na nukleyong atomiko na kung tawagin ay ‘nukleyon’ sa palagom na tawag. Ang mga dagisik (elektron) ang bumubuo sa mas malaking ulap-dagisik na bumabalot sa nukleyo. Ngayon sinasabing ang mga proton at neutron ay binubuo ng mga mas elementaryong partikula pa na tinatawag na quarks.
Magkakapareho ng bilang ng proton (na tinatawag ng bilang na atomiko nito) ang mga atomo ng isang elemento. Sa loob ng isang solong elemento, maaring may pagkakaiba sa bilang ng neutron sa atomo nito, na nagtatakda sa kanyang isotopo (aysotop). Ang bilang ng dagisik (elektron) na kasangkot sa isang atomo ay madaling baguhin dahil sa mas mababang enerhiyang kawing ng mga dagisik. Maari ring magbago ang bilang ng proton (at ng neutron) sa nukleyo atomiko sa pamamagitan ng pagsasanib nukleyar, pagwawalay nukleyar, pagbomba na gumagamit ng subatomikong partikula na may mataas na energhiya o ng mga photons, o ilang tiyak na radiaktibong pagkabulok. Sa prosesong ito na kung saan ang bilang ng proton ay nagbago, ang atomo na pumailalim rito ay naging isang atomo ng isang kakaibang elementong kimikal.
Ang atomo ay neutral sa kuryente kung pareho ang bilang ng proton at dagisik (elektron) nito. Ang mga atomong kapos o sobra sa dagisik ay tinatawag na iono. Ang pikamalayong dagisik sa nukleyo ay maaring lumipat o maglagalag sa mga katabing atomo o pagsaluhan ng ibang atomo. Sa pamamigitan ng mekanismong ito nagkakawing-kawing ang mga atomo upang makabuo ng molekula at iba pang uring ng kompuwestong kimikal tulad ng kristal na may kawing ioniko at kawing kobalente.
Ang mga atomo at molekula

Sa mga gas at ilang molekulang likido at solid (tulad ng tubig at asukal), ang molekula ang pinakamaliit na paghahati ng materya na kung saan nananatili ang katangiang kimikal nito. Alalaumbaga, marami ring mga solid at likido na gawa sa atomo ang hindi binubuo ng isang malinaw na molekula (tulad ng maraming klase ng asin, batong mineral, at solid at likidong metal). Dahil dito, kahit karaniwan ang mga molekula sa mundo (na bumubuo sa ating papawirin at karagatan), ang kayarian ng mundo (halos lahat ng matigas nito balat hanggang sa ubod nito) ay hindi masasabing malinaw ng gawa sa mga molekula kundi binubuo ito ng atomikang materya na may kakaibang kayarian na walang partikular na kaayusan (yaun bang, malakas na pinagkawing-kawing na mga atomo na pinagniniig sa pamamagitan ng ibang kalipunan ng mga atomo na may mas mahinang puwersa) na mailalakip sa materyang molekular.
Karamihan ng mga molekula ay gawa ng iba’t-ibang atomo. Halimbawa, ang molekula ng tubig ay binubuo ng dalawang atomo ng hidroheno at isang atomo ng oksiheno. Ang katagang “molekula” sa mga gas ay ginagamit na sinonimo sa mga pundamental na partikula ng gas anuman ang estruktura nito. Ang pagtatakdang ito ay nagbunga ng iilang uri ng gas (halimbawa ang mga inert na elemento na hindi nakabubuo ng kompuwesto tulad ng neon) na may mga “molekula” lamang ng iisang atomon.
Pinagmulan ng mga atomo
Sinasabing ang unang nukleyo kasama ang nukleyo ng helio at lahat ng deuterio sa sangkalawakan ay nilalang noong nukleyosintesis ng malaking pagsabog (big bang), mga 3 minuto matapos ang malaking pagsabog. Ang unang atomo ay nilalang 380,000 taon matapos ang malaking pagsabog na tinatawag na epoka ng rekombinasyon nang lumamig ang sangkalawakan kung saan sumanib ang mga dagisik (elektron) sa mga nukleyo. Mula noon, nagsasanib ang mga atom sa mga bituin sa pamamagitan ng pagsasanib nukleyar hanggang makabuo ng atomo (hanggang bakal [yero]). May ilang atomo tulad ng 6Li ang nabubuo sa kalawakan sa pamamagitan ng cosmic ray spallation. Ang mga elementong higit na mabigat kaysa yero ay ginagawa sa mga supernoba sa pamamagitan ng r-process at sa mga bituing AGB sa pamamagitan ng s-process. Ang ilang elemento tulad ng tingga (plomo) ay nalalalang sa pamamagitan ng radyaktibong pagkabulok ng mga mabibigat na elemento. Karamihan sa mga atomong kayarian ng lupa at sa lahat ng nakatira rito ay narito na sa kasalukuyang porma mula sa nebula na nagbuo sa ating kalawakang araw. Ang natitira ay bunga ng radyaktibong pagkabulok at kung saan ang kanilang proporsyon ay magagamit upang alamin ang edad ng ating mundo sa pamamagitan ng radyometrikong pagtutuos sa edad nito. Marami sa helio sa mundo ay bunga ng pagkabulok-alpa.
May ilang katiting na atomo sa lupa na wala noong una at hindi rin bunga ng radyaktibong pagkabulok. Ang karbon-14 ay patuloy na ginagawa ng mga kosmikong rayos sa papawirin. Ang ilang atom sa mundo ay artipisyal na tahasang ginawa o bunga ng mga reaktor nukleyar o pagsabog nukleyar kasama ang lahat ng plutonio at teknesio sa lupa.
Mga sanggunian
- Nagmula sa artikulong Atom ng Wikipedia sa Wikang Ingles.
- ↑ Firth, Lesley (Patnugot Panlahat) atbp. (1985). "Atoms, Leucippus, Who First Thought of Atoms?, Science and Technology". Who Were They? The Simon & Schuster Color Illustrated Question & Answer Book. Little Simon Book, Simon & Schuster, Inc., Lungsod ng Bagong York, ISBN 0671604767., pahina 43.
- ↑ Maugnaying Talasalitaang Pang-agham Ingles-Pilipino, 1969.
Padron:Link FA Padron:Link GA Padron:Link GA Padron:Link FA Padron:Link FA Padron:Link FA
