Hinuhang atomiko
Ang artikulong ito ay nangangailangan ng maayos na salin. (Enero 2014) |
Sa kimika at pisika, ang hinuhang atomika (Ingles: atomic theory) ay isang hinuha sa kalikasan ng materya na kung saan tinutukoy na ang materya ay binubuo ng hiwalay at malinaw na bahagi na tinatawag na atomo. Ito ay kakaiba sa matandang paniwala na ang materya ay mahahati sa mga arbitrayong laki.
Ang hinuhang atomika ay nagsimula libong taon ang nakalilipas bilang kaisipang pangpilosopiya at noong siglo 19 kung kailan natamo nito ang malawak na pagtanggap sa agham. Salamat sa mga tuklas sa larangan ng estoikiyometriya. Ang mga kimiko noong mga panahong yaon ay naniniwala na ang pinakapundamental na yunit ng mga elemento ay mga partikulang pundamental ng kalikasan na tinatawag na atomo (mula sa salitang Griyegong atomos, na may kahulugang “di nahahati”). Subalit, sa pagpasok ng siglo 20 sa pamamagitan ng ibat-ibang eksperimento sa elektromagnetismo at radyaktibidad, natuklasan ng mga pisiko na ang “di nahahating atomo” ay binubuo pala ng mga iba’t-ibang subatomikong partikula (tulad ng elektron, proton at neutron) na maaring uminog ng hiwalay sa isa’t-isa. Sa katunayan, sa ilang matitinding paligid tulad ng mga bituing neutron, hindi umiinog ang mga atomo dahil sa napakatinding na temperatura at presyon. Ang larangan ng agham na nag-aaral ng mga subatomikong partikula ay tinatawag na pisika partikula at sa larangang ito, umaasa ang mga pisiko na matutuklasan ang tunay ng pundamental na kalikasan ng materya.
Atomismong pangpilosopika
[baguhin | baguhin ang wikitext]Indio
[baguhin | baguhin ang wikitext]Hanggang sa bungad ng siglo 19, ang atomikong hinuha ay kalimitang pangpilosopiya na hindi ipinundar sa maka-agham na eksperimentasyon. Ang mga unang hinuha ay pinaunlad sa matandang India noong siglo 6 BCE ni Canada, isang pilosopong Hindu. Sa pilosopiyang Hindu, ibinunsad ng paaralang Nyaya at Vaisheshika ng mga masalimuot na hinuha kung papaano nagsasanib upang makabuo ng mas kumplikadong bagay (sa una ay pares-pares, matapos tatluhan ng mga pares). Pinaniniwalaan na ang pagniniig na mga ito ay kagustuhan ng Diyos (espesipiko rito ang Ishvara ng mga Hindu). Sinasabing walang kakayahan ang mga atomo kung walang itong katangiang pisikal. Balintuna rito, ang pilosopiyang Jainiko na nagsasangkot sa ugali ng materya sa likas raw mismo ng mga atomo. Ayon sa pilosopiyang Jaina, ang bawat atomo ay mayroong sariling lasa, amoy at kulay at dalawang uri ng hipo. Hindi maliwanag kung ano ang pakahulugan ng “uri ng hipo”. Sinasabing ang mga atomo ay umiinog sa isa sa dalawang katayuan nito: mahinhin, kung saan na napapasok nito ang gaano mang kaliit na lugar, at ang magaspang kung saan ito ay kumakasya lamang sa isang tiyak na lugar. Kahit na gawa ang mga atomo ng makakamukhang sustansiya, makapagsasanib sila sa isa’t-isa ayon sa kanilang mga walang-hanggang katangiang upang makabuo ng anim na “kinapal” na halos katugon sa konseptong Grieyego ng mga “elemento”: lupa, tubig, anino, damdamin, materyang karmiko, at materyang di-kasya.[1]
Griyego
[baguhin | baguhin ang wikitext]Sina Leucippus at Democritus, na mga pilosopong Griyego noong siglo 5 BCE, ay nagbunsad ng kanilang hinuha ng mga atomo. Naniniwala ang mga Griyego na ang mga atomo ay gawa ng pare-parehong sangkap ngunit may iba’t-ibang hugis at laki na nagtatakda sa mga katangiang pisikal ng isang materyal. Halimbawa, ang mga atomo ng isang likido ay sinasabing makinis na nagpapadulas sa bawat isa.[2] Sa kaisipang ganito, sinasabing ang grapito at diyamante ay binubuo ng dalawang uri ng atomo. Alam natin ngayon na sila ay pormang allotropiko lamang ng carbon.
Musulmano (Islamiko)
[baguhin | baguhin ang wikitext]Noong siglo 11 (noong Gintong Edad Musulmano), ibinunsad ng mga atomistang Musulmano ng mga atomikong hinuha na nagtatagni sa atomismong Griyego at Indio. Lalong pinagyaman ng mga atomistang Musulmano ang matatandang ideyang Griyego at Indio kasama ang mga bagong ideyang Musulmano katulad ng posibilidad na mayroong pang mas maliliit na partikula kaysa atomo. Ang pinakamatagumpay na porma ng atomismong Musulmano ay mula sa paaralang pilosopiya ng Asharite bantog rito ang gawa ng pilosopong si al-Ghazali (1058-1111). Sa atomismong Asharite, ang atomo lamang ang materyal na bagay na walang hanggan at ang lahat ay “aksidente” na nagtatagal sa isang kisap lamang. Maliban sa pakiramdam, kundi aksidente ang dahilan ng lahat, hindi ito panandalian lamang. Ang mga pangyayaring magkakasabay ay sinasabing hindi sumasailalim sa likas na kadahilanan bagkus bunga ito ng palagiang pakiki-alam ng Diyos, walang mangyayari kung wala siya. Dahil dito umaasa ang kalikasan sa Diyos na sumasala sa ibang ideyang Musulmano ng Ashirite tungkol sa kadahilan o kawalaan nito. [3]
Makabagong hinuhang atomika
[baguhin | baguhin ang wikitext]Pagsilang
[baguhin | baguhin ang wikitext]Noong bungad ng siglo 19, ibinunsad ni John Dalton ang kanyang hinuhang atomika kung saan kanyang iminungkahi na ang bawat elementong kimikal ay binubuo ng iisang uri ng atomo. Maari silang makipagsanib kahit na sila ay di masisira at di nagbabago upang makabuo ng mas kumplikadong estruktura (kompuwestong kimikal). Hindi malinaw kung papaano niya nilinang ang hinuhang ito. Gayunpaman, nagbigay ito ng paliwanag sa ilang palaisapan sa kimika sa kanya at kanyang mga kasabay noong panahong iyon.
Ang una ay ang pagpapanatili ng bigat na binalangkas ng Antoine Lavoisier noong 1789. Tinutukoy nito na ang kabuuang bigat sa isang kimikong pagsasanib ay di nagbabago (yaon bang ang bigat ng magsasanib at produkto ay magkatumbas). [4] Ang batas na ito ang nagpanukala kay Dalton na ang isang materya ay hindi magigiba.
Ang pangalawa ay batas ng tiyak na proporsyon. Unang pinatunayan ng kimikong Pranses na si Joseph Louis Proust noong 1799,[5]sinasabi ng batas na ito kapag ang isang kompuwesto ay bumalik sa kanyang mga pinagmulang elemento, ang mga bigat nito ay laging pareho sa proporsyon gaano man karami o anuman ang pinagmulan ng orihinal na sustansiya. Nagsintensis si Proust ng carbonato ng tanso (copper carbonate) na gumamit ng iba’t-ibang paraan at kanyang nasumpungan na sa bawat kaso, ang mga ingredyente ay nagsasama ng may parehong proporsyon na parang ginagawa kapag giniba ito mula sa likas na carbonato ng tanso.
Pinag-aralan at pinalawak ni Dalton ang trabaho ni Proust na nagbunsad sa batas ng multipleng proprosyon: na nagsasaad na kapag ang dalawang elemento ay nakabubuo ng mahigit sa isang kompuwesto, ang ratio ng bigat ng ikalawang elemento na nakikipagsanib sa isang tiyak na bigat ng unang elemento ay ratio ng maliliit ng integer nito. Ang isang pares ng pagsasanib na pinaniniwalaang pinag-aralan ni Dalton ay ang oksido nitriko (nitric oxide) (NO) at oksiheno (oxygen) (O<su>2). Sa isang pagsasanib, nabubuo nito ang trioksido dinitroheno (dinitrogen trioxide) (N2O3). Subalit kapag inulit ang pagsasanib na ito na gumagamit ng dalawang beses na dami ng oksiheno (ang ratio na 1:2 – maliit na integer), nagbubunga ito ng dioksido nitroheno (nitrogen dioxide) (NO2).
4NO + O2 → 2N2O3
4NO + 2O2 → 4NO2
Si Dalton ay naniniwala rin na ang hinuhang atomika ay makapagpapaliwanag kung bakit humihigop ang tubig ng iba’t-ibang gas na may iba’t-ibang proporsyon. Halimbawa, kanyang nasumpungan na mainam higupin ng tubig ang dioksido ng carbon (carbon dioxide) kaysa nitroheno. Huna-huna ni Dalton na ito ay dahil sa mga pagkakaiba sa bigat at kompleksidad ng mga kanya-kanyang partikula ng mga gas. Sa totoo, mas mabigat at malaki ang mga molekula ng dioksido ng carbon (CO2) kaysa mga molekula ng nitroheno (N2).

Noong 1803, naglathala si Dalton ng una niyang listahan ng relatibong bigat atomiko ng mga ilang sustansiya [6](kahit na hindi niya tinalakay sa publiko kung papaano niya nakuha ito hanggang 1808). Tinantya ni Dalton ang mga bigat atomiko ayon sa ratio ng bigat ng kanilang pagsasanib kung saan ang hidroheno ang ugat na yunit. Subalit, hindi inisip ni Dalton na ang ilang elementong atomo ay umiiral rin bilang molekula – halimbawa ang dalisay ng oksiheno ay umiinog bilang O2. Mali ang paniwala niya na ang pinakasimpleng kompuwesto sa pagitan ng dalawang elemento ay laging isang atomo isa’t-isa (inisip niya na ang tubig ay HO, hindi H2O). Kasama ang kapayakan ng kanyang aparato, maraming mali sa kanyang talaan. Halimbawa, paniwala niya na ang atomo ng oksiheno ay 5.5 beses na mabigat kaysa atomo ng hidroheno dahil sinukat niya na ang tubig ay may 5.5 gramo ng atomong oksiheno sa bawat 1 gramo ng atomong hidroheno. Dahil dito paniwala niya na ang pormula ng tubig ay HO (alam natin ngayon ang atomong oksiheno ay 16 beses na mas mabigat kaysa atomong hidroheno.)
Ang mali sa hinuha ni Dalton ay itinama noong 1811 ni Amedeo Avogadro. Nagpanukala si Avogadro na ang dalawang gas na magkatumbas sa volume sa magkaparehong temperatura at presyon ay naglalaman ng magkatumbas ng bilang ng mga molekula (sa madaling salita, ang bigat ng mga partikula ng isang gas ay walang apekto sa volume nito). [7] Ang batas Avogadro ay nagpakita sa kanya upang mahulaan ang diatomikong likas ng maraming gas sa pamamagitan ng pag-aaral ng mga volume kapag sila’y nakikipagsanib. Halimbawa, dahil ang dalawang litro ng hidroheno ay makikipagsanib lamang sa isang litro ng oksiheno upang makagawa ng dalawang litro ng singaw tubig (sa konstanteng presyon at temperatura), nangangahulugang ang isang molekula ng oksiheno ay nahahati sa dalawa upang makabuo ng dalawang partikula ng tubig. Dahil dito, nakapagbigay ng mas tamang estimasyon si Avogadro sa atomikong bigat ng oksiheno at maraming pang elemento. Ito rin ang nagpatatag sa pagkakaiba sa pagitan ng molekula at atomo.
Noong 1827, namatyagan ng Britanyong botanista na si Robert Brown na ang mga partikulang alikabok na nakalutang sa tubig ay walang tigil na naaalog nang walang kadahilanan. Noong 1905, huna ni Albert Einstein na ang kilos Brownian na ito ay dulot ng molekula ng tubig na walang tigil na bumabangga sa mga butil sa palibot nito. Kanyang dinebelop ang isang hipotetiko at matematikong modelo upang ipaliwanag ito.[8] Napatunayan ang modelong ito sa pamamagitan ng eksperimento noong 1911 ng Pranses ng pisikong si Jean Perrin na nagbigay ang dagdag na pagpapatoo sa hinuhang partikula (at pagpapalawig ng hinuhang atomika).
Pagkakatuklas ng mga subatomikong partikula
[baguhin | baguhin ang wikitext]
Sinasabing ang mga atomo ay pinakamaliit na paghahati ng materya hanggang 1897 nang matuklasan ni J.J. Thomson ang elektron sa pag-aaral niya ng cathode ray tubes.[9] Ang cathode ray tube na ginamit ni Thomson ay isang saradong lalagyang bubog na kung saan ang dalawang elektrod ay pinaghiwalay ng vacuum. Kapag ang ang boltahe ay pinaagos sa dalawang elektrod, nagbubunga ito ng cathode rays na ipikikita na isang nagbabagang patsa sa tinatamaang bahagi ng bubog sa kabilang dulo ng tubo. Sa pamamagitan ng eksperimentasyon, natuklasan rin ni Thomson na mga rayos na ito ay napalilihis ng larangang elektrikal (at larangang magnetiko na alam na noon). Kanyang ipinalagay na ang mga rayos na ito, sa halip na mga onda, ay binubuo ng mga partikulang may negatibong kargada na tinawag niyang “korpuskula” (na tinawang na elektron nang lumaon ng ibang siyentipiko)
Paniwala ni Thomson na ang mga korpuskula ay nagmula sa mga atomo ng elektrod. Dahil dito ipinalagay niya na ang mga atomo ay nahahati at ang mga korpuskula ang bumubuo rito. Upang maipaliwanag ang kabuuang neutral na karga na atomo, kanyang iminungkahi na ang mga korpuskula ay nakakalat na pahaba-bilog na balangkas sa pantay na dagat o ulap ng positibong karga na tinawag na plum pudding model.[10]
Sa dahilang napatunayan na tunay na nahahati ang atom, inimbento ng mga pisiko ang katagang “elementaryong partikula” upang ipaliwanag ang mga partikulang hindi na mahahati pa. Pagkatuklas ng nukleyo

Itaas: Inaasahang resulta: ang mga partikulang alfa ay lalagos sa plum pudding model ng atomo nang halos walang paglihis.
Ibaba: Namatyagang resulta: kaunti ng mga partikula ang lumihis na nagpapakita ng isang maliit at siksik ng positibong karga
Ang modelong plum pudding ni Thomson ay pinabulaanan noong 1909 ng isa niyang estudyante, si Ernest Rutherford, na nakatuklas sa kalakhan ng bigat at positibong karga ng isang atomo ay nakasiksik sa isang napakaliit na bahagi sa kabuuang laki nito sa ubod nito.
Sa eksperimento sa pohas na ginto, pinaputukan ng mga partikulang alfa nina Hans Geiger at Ernest Marsden ang isang pohas na ginto (na tumama sa isang fluorescent screen na nakapalibot sa pohas). [11] Dahil sa napakaliit ng bigat ng mga elektron, ang mataas ng momento ng mga partikulang alfa at kalat na distribusyon ng kargang positobo ng modelong plum pudding, itinaya ng mga sumubok na ang lahat ng partikulang alfa ay lulusot ng halos makitang paglihis o paghigop nito. Nagulat sila nang may maliit na bahagi ng mga partikulang alfa ang nakaranas ng malaking paglihis. Ito ang nagpakita kay Rutherford upang magmungkahi ng planetaryong modelo ng atomo na kung saan ang mga elektron ay lumiligid sa isang siksik at mabigat na nukleyo –katulad ng pag-ikot ng mga tala sa Araw. [12]
Pagkakatuklas ng mga aysotops
[baguhin | baguhin ang wikitext]Noong 1913, pinadaloy ni JJ Thomson ang isang agos ng mga iono ng neon sa loob ng larangang magnetiko at elektrikal at pinatama ito sa isang potograpikong pelikula sa kabilang ibayo. Kanyang namatyagan na may dalawang patsa sa pelikula na nangangahulugan ng dalawang magkaibang landas. Ipinalagay ito ni Thomson na ito ang ilang iono ng neon ay may kakaibang bigat at kaya sinasabi niyang nasumpungan ang pag-inog ng mga aysotops. [13]
Pagkakatuklas sa mga partikulang nukleyar
[baguhin | baguhin ang wikitext]Noong 1918, hinati ni Rutherford ang nukleyo ng atomo ng kanyang bombahin ang gas ng nitroheno ng mga partikulang alfa at kanyang namatyagan na nagpalabas ito ng mga nukleyo ng hidroheno. Ipinalagay ni Rutherford na ang nukleyong hidroheno ay lumitaw mula sa nukleyo mismo ng mga atomo ng nitroheno. [14] Nang lumaon kanyang nasumpungan na ang positibong karga ng anumang atomo ay maitutumbas sa isang integer na bilang ng nukleyo ng hidroheno. Ito, kalakip ang katotohanan na ang hidroheno bilang pinakamagaang na elemento – ay may atomikong bigat na 1 ay kanyang ipinalagay na ang nukleyo ng hidroheno ay iisahing partikula na nilalaman ng lahat ng nukleyo ng atomo: ang proton. Matapos ang marami pang eksperimento, natuklasan ni Rutherford na ang bigat nukleyar ng karamihan ng mga atomo ay mahigit sa nilalaman nitong mga proton. Kanyang hinulaan na ang sobra nito ay binubuo ng hindi pa tiyak ng mga partikulang neutral.
Noong 1928, namatyagan ni Walter Bothe na nagpapalabas ang berilyo ng radyasyong may neutral na karga kapag binomba ng partikulang alfa. Noong 1932, inilantad ni James Chadwick ang maraming elemento sa radyasyong ito na kanyang ikinumpara ang mga enerhiya ng sumisikad na kargadong partikula mula sa iba’t-ibang target. Kanyang ipinalagay na ang radyasyon ay binubuo ng neutral na mga partikula na may bigat malapit sa proton. [15] Tinawag itong mga partikulang “neutron” ni Chadwick.
Kwantikong modelo ng atomo
[baguhin | baguhin ang wikitext]May kakulangan ang planetaryong modelo ng atomo. Una, ayon sa pormula ni Larmor sa klasikong elektromagnetismo, ang matuling kargadong elektron ay nagpapalabas ng mga ondang elektromagnetiko; ang isang lumiligid na kargadong elektron ay unti-unting mawawalan ng lakas (enerhiya) sa pagbulusok nito sa nukleyo kung saan dagling sasalpok ito. Ang isa pang balagha na hindi maipaliwanag ng modelong ito ay kung bakit ang mga sabik na atomo ay nagpapalabas lamang ng liwanag sa loob ng hiwalay at malinaw na espektra.
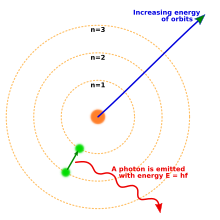
Napakalaking pagbabago sa pisika ang dulot ng hinuhang kwantika noong bungad ng siglo 20 nang magpostula sina Max Planck at Albert Einstein na ang liwanag ay inilalabas o hinihigop sa tiyak na dami na tinatawag ng kwanta (isahan, kwantum). Noong 1913, isinama ni Niels Bohr ang ideyang ito sa kanyang modelong Bohr ng atomo na kung saan ang mga elektron ay makaliligid lamang sa nukleyo sa isang partikular ng pabilog na pagligid na may tiyak ng momentong angular at enerhiya at kung saan ang layo nito sa nukleyo ay proporsyonal sa kanya-kanyang enerhiya [16] Sa modelong ito hindi unti-unting bubulusok ang mga elektron sa nukleyo dahil hindi sila tuluyang mawawalan ng enerhiya; sa halip kisapmatang makaluluksong kwantiko lamang sila sa pagitan ng tiyak ng nibel ng enerhiya. [16] Kapag nangyari ito, nagpapalabas o humihigop ito ng liwanag na may prekwensiyang proporsyonal sa pagbabago ng enerhiya (at kaya ang paghigop at pagpapalabas ng liwanag ng tiyak at malinaw na espektra). [16]
Nahulaan lamang ng modelo ni Bohr ay linyang espektral ng hidroheno. Hindi nito mahulaan kung ang atomo ay multi-elektron. Ang masama pa rito, noong lumawig ang teknolohiyang espektrograpika, may mga karagdagong linyang espektral ang bagong namatyagan na hindi rin maipaliwanag ng modelong Bohr. Noong 1916, nagdagdag ng eliptikong ligiran si Arnold Sommerfeld sa modelong Bohr upang ipaliwanag ang dagdag na palabas na mga linya na nagpahirap sa paggamit ng modelong ito. Hindi rin nito maipaliwanag ang mga kumplikadong atomo. Noong 1924, nagmungkahi si Louis de Broglie na ang lahat ng bagay – partikular ang mga subatomikong partikula tulad ng elektron – ay nagpapakita ng ugaling parang onda (alon). Naakit si Erwin Schrodinger sa ideyang ito at kanyang sinubukan kung mas mainam na ipaliwanag ang kilos ng isang elektron bilang isang onda kaysa isang partikula. Ang ekwasyon ni Schrodinger ay inilathala noong 1926 [17]na nagpapaliwanag sa isang elektron bilang isang punsiyong-alon sa halip na isang partikulang tuldok. Eleganteng naipaliwanag nito ang mga balaghang espektral na hindi maipaliwanag ng modelong Bohr. Kahit na konbinyente ito sa paggamit ng matematika, mahirap itong maisalarawan at marami ang laban dito [18] Isa sa mga kritiko nito ay si Max Born na nagmungkahi na ang punsiyong-onda ni Schrodinger ay hindi nagpapaliwanag sa elektron bagkus sa lahat ng posibleng katayuan (estado) at sa gayon ay magagamit ito sa pagtutuos sa probabilidad upang masumpungan ang isang elektron sa isang tiyak na lokasyon sa paligid ng nukleyo. [19]
Noong 1927, itinuro ni Werner Heisenberg na dahil isinasama ng isang punsiyon-onda ang panahon at posisyon, imposibleng mahalaw ng magkasabay ang tiyak na halaga ng posisyon at momento ng isang partikula sa isang alam na panahon[20]; ito ay naging kilala bilang prinsipyo ng walang katiyakan.

Ang bagong landas na ito ay nagpawalang halaga sa modelong Bohr dahil sa malinaw at malinis ng itinakdang bilog na ikot nito. Ang makabagong modelo ng atomo ay nagpapakita ng posisyon ng mga elektron sa isang atomo sa pamamagitan ng probabilidad. Sa padrong ito na tinatawag na atomic orbital (ligirang atomika), ang isang elektron ay malamang na masusumpungan anumang layo sa nukleyo subalit – depende sa nibel ng enerhiya nito – may tiyak kinikilingang rehiyon ito sa paligid ng nukleyo.
Mga Nota
[baguhin | baguhin ang wikitext]- Isang pagsasalin ng artikulong "Atomic theory" ng English Wikipedia.
- 1. ^ Gangopadhyaya, Mrinalkanti. Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press, 1981. ISBN 0-391-02177-X
- 2. ^ History of Atomic Theory, encarta.msn.com, Last accessed 26 Nobyembre 2006
- 3. ^ Gardet, L. “djuz’” in Encyclopaedia of Islam CD-ROM Edition, v. 1.1. Leiden: Brill, 2001.
- 4. ^ Lavoisier, Antoine (1743-1794), scienceworld.wolfram.com; Last accessed on 13 Pebrero 2007
- 5. ^ Joseph Louis Proust (1799), Researches on Copper
- 6. ^ John Dalton (1803), On the Absorption of Gases by Water and Other Liquids
- 7. ^ Amedeo Avogadro (1811), Essay on a Manner of Determining the Relative Masses of the Elementary Molecules of Bodies, and the Proportions in Which They Enter into These Compounds
- 8. ^ Albert Einstein (1905), On the Movement of Small Particles Suspended in Stationary Liquids Required by the Molecular-Kinetic Theory of Heat, Annal der Physik
- 9. ^ JJ Thomson (1897), Cathode rays, Philosophical Magazine
- 10. ^ JJ Thomson (Marso 1904), On the Structure of the Atom: an Investigation of the Stability and Periods of Oscillation of a number of Corpuscles arranged at equal intervals around the Circumference of a Circle; with Application of the Results to the Theory of Atomic Structure, Philosophical Magazine Series 6, Vol 7, No 39
- 11. ^ H Geiger (1910), The Scattering of the α-Particles by Matter, Proceedings of the Royal Society Series A 82: 495–500
- 12. ^ Ernest Rutherford (1911), The Scattering of α and β Particles by Matter and the Structure of the Atom, Philosophical Magazine Series 6, vol. 21
- 13. ^ JJ Thomson (1913), Rays of positive electricity, Proceedings of the Royal Society, A 89, 1–20
- 14. ^ Ernest Rutherford (1919), Collisions of alpha Particles with Light Atoms. IV. An Anomalous Effect in Nitrogen., Philosophical Magazine, 6th series, 37, 581
- 15. ^ James Chadwick (27 Pebrero 1932), Possible Existence of a Neutron, Nature Magazine
- 16. ^ a b c Bohr, N. (1913). On the constitution of atoms and molecules. Philosophical Magazine, 26, 1-251
- 17. ^ Erwin Schrodinger (1926), Quantisation as an Eigenvalue Problem, Annalen der Physik
- 18. ^ Dr Subodh Mahanti, Erwin Schrodinger: The Founder of Quantum Wave Mechanics, Vigyan Prasar; Last accessed 26 Nobyembre 2006
- 19. ^ Dr Subodh Mahanti, Max Born: Founder of Lattice Dynamics, Vigyan Prasar; Last accessed 26 Nobyembre 2006
- 20. ^ ISCID, Heisenberg Uncertainty Principle; Last accessed 26 Nobyembre 2006
