Atomo
| Atom ng Helium | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| Isang paglalarawan ng helium atom, na naglalarawan ang nucleus (pink) at ang mga ulap ng elektron sa pamamahagi (itim). Ang nucleus (itaas sa kanan) sa helium-4 ay sa katotohanan ng spherical, ay kasama simetriko at malapit na kahawig ng mga ulap ng elektron, kahit na para sa mas kumplikadong mga nuclei na ito ay hindi palaging ang kaso. Ang itim na bar ay isa father (6990100000000000000♠10-10 m o 6990100000000000000♠100 pm). | ||||||||
| Pag-uuri | ||||||||
| ||||||||
| Mga katangian | ||||||||
|
Ang atomo (mula sa Kastila: átomo) ay ang pinakamaliit na parte ng ordinaryong materya na mayroong mga katangian ng kemikal na elemento. Ang bawat solido, likido, gas, at plasma ay naglalaman ng mga niyutral na atomo. Napakaliit ng mga atomo, ang kanilang mga tipikal na laki ay nasa isang daang pikometro. Sa sobrang liit ng mga atomo, ang pagsubok sa paghula ng ugali ng mga ito gamit ang klasikal na pisika, kagaya nang pagtrato sa mga atomo bilang mga bola ng bilyar ay nagreresulta ng mga maling prediksyon. Sa pamamagitan ng pagsulong ng pisika, ang mga modelong atomo ay may sangkap ng mga prinsipyo ng quantum upang mas maiging ma-ipaliwanag at mahulaan ang pag-uugali na ito.
Ang bawat atomo ay binubuo ng nukleyus at isa o higit pang elektron na naka-palibot sa nukleyus. Ang nukleyus ay binubuo ng isa o higit pang protons at neutron na may karaniwang parehong bilang. Mahigit 99.94% ng bigat ng atomo ay nasa nukleyus nito. Ang mga protons ay mayroong positibong electric charge, ang mga elektron naman ay mayroong negatibong electric charge, at ang mga neutrons ay walang electric charge. Kung pareho ang bilang ng mga protons at elektrons, ang atomo ay niyutral. Kung ang atomo ay may higit o mas mababang bilang ng elektron kaysa sa protons, mayroon itong kabuoang negatibo o positibong charge, ayon sa pagkakabanggit, at tinatawag itong ion.
Ang mga electron ng isang atom ay naaakit sa mga protons sa isang atomic nucleus sa pamamagitan ng ito elektromagnetismo. Ang mga protons at neutrons sa nucleus ay naaakit sa bawat isa sa pamamagitan ng isang iba 't ibang mga lakas, ang mga nuclear force, na kung saan ay karaniwang mas malakas kaysa sa electromagnetic puwersa repelling ang mga positibo sisingilin protons mula sa isa' t isa. Sa ilalim ng ilang mga pangyayari, ang repelling elektromagnetismo ay nagiging mas malakas kaysa sa nuclear force, at nucleon maaaring ipinalabas mula sa nucleus, umaalis sa likod ng isang iba ' t ibang mga elemento: nuclear pagkabulok na nagreresulta sa nuclear pagpapabagu-bago.
Ang bilang ng proton sa nukleyo ay tumutukoy sa kung ano ang kemikal na elemento ang atom ay kabilang ang: halimbawa, ang lahat ng tanso atoms naglalaman ng 29 protons. Ang bilang ng neutron tumutukoy sa mga isotopo ng mga elemento. Ang bilang ng mga electron impluwensya ang magnetic katangian ng isang atom. Mga Atoms ay maaaring maglakip sa isa o higit pang mga atomo sa pamamagitan ng kemikal bono upang bumuo ng mga compounds kemikal tulad ng molecules. Ang kakayahan ng mga atoms upang iugnay at maghiwalay ay responsable para sa karamihan ng mga pisikal na mga pagbabago na-obserbahan sa likas na katangian at ito ay ang paksa ng ang disiplina ng kimika.
Kasaysayan ng atomic teorya
[baguhin | baguhin ang wikitext]Mga Atoms sa pilosopiya
[baguhin | baguhin ang wikitext]Ang ideya na ang mga bagay na ito ay binubuo ng hiwalay na mga yunit ay isang napaka-lumang ideya, na lumilitaw sa maraming sinaunang kultura tulad ng Greece at Indya. Ang salitang "atom" ay likha sa pamamagitan ng mga sinaunang griyego philosophers na ang Nakalilipas at ang kanyang mga mag-aaral Democritus.[1][2] Gayunpaman, ang mga ideya ay itinatag sa pilosopiko at teolohiko pangangatwiran sa halip na katibayan at pag-eksperimento. Bilang isang resulta, ang kanilang mga pananaw sa kung ano ang atoms hitsura at kung paano kumikilos ang mga ito ay hindi tama. Sila rin ay hindi maaaring kumbinsihin ang lahat ng tao, kaya leucipo ay ngunit ang isa sa isang bilang ng mga pagtutunggali ng mga theories sa likas na katangian ng mga bagay na ito. Ito ay hindi hanggang sa ika-19 na siglo na ang mga ideya ay niyakap at pino sa pamamagitan ng mga siyentipiko, kapag ang blossoming agham ng kimika ginawa tuklas na lamang ang konsepto ng mga atoms ay maaaring ipaliwanag.
Unang teoryang may basehan
[baguhin | baguhin ang wikitext]
Sa unang bahagi ng 1800s, John Dalton na ginagamit ang konsepto ng atomo upang ipaliwanag kung bakit ang mga elemento laging reaksyon sa mga ratio ng mga maliliit na mga buong numero (ang batas ng maramihang mga sukat). Halimbawa, mayroong dalawang uri ng mga lata oksido: ang isa ay 88.1% lata at 11.9% oxygen at ang iba pang ay 78.7% lata at 21.3% oxygen (tin(II) oksaid at tin dioxide ayon sa pagkakabanggit). Ito ay nangangahulugan na ang 100g ng lata ay pagsamahin ang alinman sa 13.5 g o 27g ng oxygen. 13.5 at 27 form ng isang ratio ng 1:2, isang ratio ng mga maliliit na mga buong numero. Ito ang mga karaniwang pattern sa kimika iminungkahing upang Dalton na mga elemento ng reaksyon sa multiple ng hiwalay na mga yunit — sa ibang salita, ang atomo. Sa kaso ng mga lata oxides, isang lata ng atom ay pagsamahin na may alinman sa isa o dalawang atoms oxygen.[3]
Dalton naniniwala rin atomic teorya ay maaaring ipaliwanag kung bakit ang tubig sumisipsip ng iba 't ibang mga gas sa iba' t-ibang mga sukat. Halimbawa, siya ay natagpuan na ang tubig sumisipsip ng carbon dioxide malayo mas mahusay kaysa sa ito sumisipsip ng nitrogen.[4] Dalton hypothesized na ito ay dahil sa ang pagkakaiba sa pagitan ng masa at mga configuration ng gas sa kani-kanilang mga particle, at mga molecules ng carbon dioxide (CO2) ay mas mabigat at mas malaki kaysa sa nitrogen molecule (N2).
Brownian motion
[baguhin | baguhin ang wikitext]Sa 1827, nerd Robert Brown gumamit ng isang mikroskopyo upang tumingin sa mga butil ng alikabok na nakalutang sa tubig at natuklasan na sila ay inilipat tungkol sa erratically, isang hindi pangkaraniwang bagay na ay naging kilala bilang "Brownian motion". Ito ay naisip na sanhi ng molecule ng tubig katok ang mga butil ng tungkol sa. Sa 1905, Albert Einstein di-napatutunayang ang katotohanan ng mga molecule at ang kanilang mga galaw sa pamamagitan ng paggawa ng unang Statistical physics pagtatasa ng Brownian motion.[5] pranses pisisista Jean Perrin ginagamit ng Einstein ' s trabaho sa pagtuklas matukoy ang masa at mga sukat ng mga atoms, at sa gayon ay conclusively pag-verify ng Dalton atomic teorya.
Pagtuklas ng mga elektron
[baguhin | baguhin ang wikitext]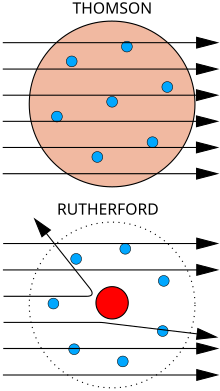
Top: Inaasahang resulta: alpha na mga particle sa pamamagitan ng pagpasa sa plum pudding model ng atomo na may bale-wala pagpapalihis.
Ibaba: Sinusunod ng mga resulta: isang maliit na bahagi ng mga particle ay pinalihis sa pamamagitan ng ang puro positibong singil ng nucleus.
Ang pisisista J. J. Thomson sinusukat ang masa ng katod ray, na ipinapakita ang mga ito ay ginawa ng mga particle, ngunit ay sa paligid ng 1800 beses na mas magaan kaysa sa mga lightest atom, hydrogen. Samakatuwid, ang mga ito ay hindi mga atoms, ngunit isang bagong maliit na butil, ang unang mga subatomic particle na natuklasan, kung saan siya orihinal na tinatawag na "korpuskulo" ngunit sa kalaunan ay pinangalanan elektron, pagkatapos ang mga particle na postulated sa pamamagitan ng George Johnstone Stoney sa 1874. Siya rin ay nagpakita na sila ay magkakahawig na mga particle ibinigay off sa pamamagitan ng photoelectric at radioactive na materyales.[6] Ito ay mabilis na kinikilala na ang mga ito ay ang mga particle na magdala ng mga de-kuryenteng alon sa metal wire, at dalhin ang mga negatibong elektrikong karga sa loob ng atoms. Thomson ay ibinigay ang 1906 Nobel Prize sa Physics para sa mga ito sa trabaho. Kaya siya binawi ang paniniwala na ang mga atomo ay ang mga hindi mapaghihiwalay, tunay na ang mga particle ng matter. Thomson din na hindi tama ang naghaka-haka na ang mababang mass, negatibong sisingilin electron ay ipinamamahagi sa buong atom sa isang pare-dagat ng positibong bayad. Ito ay naging kilala bilang ang plum pudding model.
Pagtuklas ng nucleus
[baguhin | baguhin ang wikitext]Sa 1909, Hans Geiger at Ernest Marsden, sa ilalim ng direksyon ni Ernest Rutherford, bombarded isang metal foil na may alpha particle upang obserbahan kung paano ang mga ito na nakakalat sa. Sila ay inaasahan ang lahat ng mga alpha particle upang pumasa sa tuwid sa pamamagitan ng sa maliit na pagpapalihis, dahil Thomson ' s modelo sinabi na ang mga singil sa mga atom ay kaya kalat na ang kanilang mga electric mga patlang ay maaaring hindi makakaapekto sa ang alpha particle magkano. Gayunpaman, Geiger at Marsden batik-batik alpha particle pagiging pinalihis sa pamamagitan ng mga anggulo na mas malaki kaysa sa 90°, na kung saan ay dapat na maging imposible ayon sa Thomson ' s modelo. Upang ipaliwanag ito, Rutherford ipinanukalang na ang mga positibong singil ng ang atom ay puro sa isang maliit na nucleus sa gitna ng ang atom.
Pagtuklas ng mga isotopes
[baguhin | baguhin ang wikitext]Habang nag-eeksperimento sa mga produkto ng radioactive pagkabulok, sa 1913 radiochemist Frederick Soddy natuklasan na may lumitaw na maging higit pa sa isang uri ng atom sa bawat posisyon sa periodic table. Ang kataga ng mga isotopo ay likha sa pamamagitan ng Margaret Todd bilang isang angkop na pangalan para sa iba ' t ibang mga atoms na nabibilang sa parehong mga elemento. J. J. Thomson lumikha ng isang diskarte para sa isotope paghihiwalay sa pamamagitan ng kanyang trabaho sa ionized gas, na kung saan sa dakong huli na humantong sa ang pagtuklas ng matatag isotopes.
Bohr modelo
[baguhin | baguhin ang wikitext]
Sa 1913 ang pisisista Niels Bohr iminungkahi ng isang modelo na kung saan ang mga electron ng isang atom ay ipinapalagay na nag-oorbit sa nucleus ngunit maaari lamang gawin ito sa isang tiyak na hanay ng mga orbit, at maaaring lumipat sa pagitan ng mga orbit lamang sa hiwalay na mga pagbabago ng enerhiya na naaayon sa pagsipsip o radiation ng isang poton. Ang mga quantization ay ginamit upang ipaliwanag kung bakit ang mga electron mga orbit ay matatag (ibinigay na normal na, ang mga singil sa acceleration, kabilang ang mga pabilog na galaw, mawalan ng kinetiko enerhiya na kung saan ay ipinapalabas tulad ng electromagnetic radiation, tingnan synchrotron radiation) at kung bakit ang mga elemento na maunawaan at naglalabas ng electromagnetic radiation sa hiwalay spectra.
Mamaya sa parehong taon Henry Moseley na ibinigay ng karagdagang mga pang-eksperimentong katibayan sa pabor ng Niels Bohr ' s theory. Ang mga resulta ng paghahanap pino Ernest Rutherford's at Antonius Van den Broek's modelo, na kung saan iminungkahi na ang mga atom ay naglalaman ng sa kanyang nucleus ng isang bilang ng mga positibong nuclear singil na katumbas nito (atomic) bilang sa periodic table. Hanggang sa mga eksperimento, atomic numero ay hindi kilala sa isang pisikal at pang-eksperimentong mga dami. Na ito ay katumbas ng atomic nuclear bayad ay nananatiling ang tinanggap atomic modelo ngayon.[7]
Chemical bonding ipinaliwanag
[baguhin | baguhin ang wikitext]Mga kemikal na bono sa pagitan ng mga atoms ay ngayon ipinaliwanag, sa pamamagitan ng Gilbert Newton Lewis sa 1916, pati na ang mga pakikipag-ugnayan sa pagitan ng kanilang mga manghahalal mga electron. Pati na ang mga kemikal na mga katangian ng ang mga elemento ay kilala sa kalakhan ulitin ang kanilang mga sarili ayon sa mga pana-panahong mga batas,[8] noong 1919 ang American botika Irving Langmuir iminungkahing na ito ay maaaring ipinaliwanag kung ang mga elektron sa isang atomo ay konektado o tinipong sa ilang mga paraan. Mga grupo ng mga electron ay naisip na sumasakop sa isang hanay ng mga elektron shell tungkol sa nucleus.
Karagdagang developments sa quantum physics
[baguhin | baguhin ang wikitext]Ang Stern–Gerlach na eksperimento ng 1922 ibinigay sa karagdagang katibayan ng quantum likas na katangian ng atomic mga katangian. Kapag ang isang sinag ng pilak atoms ay pumasa sa pamamagitan ng isang espesyal na hugis-magnetic field, ang ngiti ay split sa isang paraan na sang-ayon sa direksyon ng isang atom ng angular momentum, o iikot. Bilang na ito iikot direksyon ay una random, ang ngiti ay inaasahan upang magpalihis sa isang random na direksyon. Sa halip, ang mga ngiti ay split sa dalawang itinuro ng mga bahagi, na naaayon sa ang atomic iikot pag-oriented up o down na may paggalang sa ang magnetic field.
Sa 1925 Werner Heisenberg na-publish ang unang pare-pareho ang matematika pagbabalangkas ng quantum mechanics (Matris Mechanics). sa Isang taon mas maaga, sa 1924, Louis de Broglie ay iminungkahi na ang lahat ng mga particle kumilos sa isang lawak tulad ng mga waves at, sa 1926, Erwin Schrödinger na ginagamit sa ideya na ito upang bumuo ng isang matematikal na modelo ng atomo (Wave Mechanics) na inilarawan ang mga electron bilang tatlong dimensiyonal na waveforms sa halip na punto ng mga particle.
Isang kalalabasan ng paggamit ng waveforms upang ilarawan ang mga particle na ito ay na ito ay mathematically imposible upang makakuha ng tumpak na halaga para sa parehong mga posisyon at momentum ng isang maliit na butil sa isang ibinigay na punto ng oras; ito ay naging kilala bilang ang kawalan ng katiyakan prinsipyo, formulated sa pamamagitan ng Werner Heisenberg sa 1927. Sa ganitong konsepto, para sa isang naibigay na katumpakan sa pagsukat ng isang posisyon sa isa ay maaaring lamang makakuha ng isang hanay ng mga malamang na mga halaga para sa momentum, at vice versa.[9] Modelo na ito ay magagawang upang ipaliwanag ang mga obserbasyon ng atomic pag-uugali na sa nakaraang mga modelo ay maaaring hindi, tulad ng tiyak na istruktura at parang multo na mga pattern ng mga atoms mas malaki kaysa sa hydrogen. Kaya, ang planetary modelo ng atomo ay itinapon sa pabor ng isa na inilarawan sa atomic orbital zone sa palibot ng nucleus kung saan ang isang ibinigay na elektron ay pinaka-malamang na ma-obserbahan.
Pagtuklas ng neutron
[baguhin | baguhin ang wikitext]Ang pag-unlad ng mass spektrometer pinapayagan ang mga masa ng mga atoms upang ma-sinusukat sa nadagdagan katumpakan. Ang aparato ay gumagamit ng isang pang-akit upang yumuko ang tilapon ng isang sinag ng ions, at ang halaga ng pagpapalihis ay natutukoy sa pamamagitan ng ang ratio ng isang atom ng masa sa kanyang mga singil. Ang botika Francis William Aston na ginagamit ito sa mga instrumento upang ipakita na ang mga isotopo ay nagkaroon ng iba ' t ibang mga masa. Ang atomic mass ng mga isotopes iba ' t-ibang sa pamamagitan ng mga halaga ng integer, na tinatawag na mga buong numero sa patakaran. Ang mga paliwanag para sa mga iba ' t ibang mga isotopes kasabik-sabik ang pagtuklas ng neutron, isang uncharged maliit na butil na may isang masa katulad ng proton, sa pamamagitan ng pisisista James Chadwick sa 1932. Isotopes ay pagkatapos ay ipinaliwanag bilang mga elemento na may parehong bilang ng mga protons, ngunit iba ' t ibang mga numero ng neutrons sa loob ng nucleus.
Fission, mataas na enerhiya physics at condensed matter
[baguhin | baguhin ang wikitext]Sa 1938, ang aleman botika Otto Hahn, ang isang mag-aaral ng Rutherford, nakadirekta sa neutrons papunta sa yureyniyum atoms umaasa upang makakuha ng transuranium mga elemento. Sa halip, ang kanyang mga kemikal na mga eksperimento ay nagpakita ng barium bilang isang produkto. ang Isang taon mamaya, Lise Meitner at ang kanyang pamangking lalaki Otto Frisch - verify na Hahn ' s resulta ay ang unang pang-eksperimentong mga nuclear fission. Sa 1944, Hahn natanggap ang Nobel prize sa kimika. Sa kabila ng Hahn ' s pagsisikap, ang mga kontribusyon ng Meitner at Frisch ay hindi kinikilala.
Sa 1950s, ang pag-unlad ng pinabuting maliit na butil accelerators at maliit na butil detector pinapayagan ang mga siyentipiko upang pag-aralan ang mga epekto ng mga atoms paglipat sa mataas na energies. Neutrons at protons ay nahanap upang maging mga hadron, o composites ng mas maliit na mga particle na tinatawag na quarks. Ang standard na modelo ng tipik physics ay binuo na sa ngayon ay matagumpay na ipinaliwanag ang mga katangian ng nucleus sa mga tuntunin ng mga sub-atomic particle at ang mga pwersa na pamahalaan ang kanilang mga pakikipag-ugnayan.
Istraktura
[baguhin | baguhin ang wikitext]Subatomic particle
[baguhin | baguhin ang wikitext]Kahit na ang mga salita atom orihinal na naka-denote ng isang maliit na butil na hindi maaaring i-cut sa mas maliit na particle, na sa modernong pang-agham na paggamit ng ang atom ay binubuo ng iba ' t ibang mga subatomic particle. Ang mga manghahalal mga particle ng atom ay ang elektron, proton at neutron; lahat ng tatlong ay ang mga fermion. Gayunpaman, ang hydrogen-1 atom ay walang neutrons at ang hydron ion ay walang mga electron.
Ang elektron ay sa pamamagitan ng malayo ang pinaka-napakalaking ng mga particle sa 9.11×10-31 kg, na may isang negatibong mga de-koryenteng singil at isang sukat na iyon ay masyadong maliit upang maging sinusukat gamit ang mga magagamit na mga pamamaraan.[10] Ito ay ang lightest maliit na butil na may isang positibong natitirang bahagi ng masa sinusukat, hanggang sa ang pagtuklas ng mga neutrino masa. Sa ilalim ng mga ordinaryong mga kondisyon, ang mga electron ay nakasalalay sa mga positibo sisingilin nucleus sa pamamagitan ng ang pang-akit na nilikha mula sa tapat ng electric singil. Kung ang isang atom ay higit pa o mas kaunting mga electron kaysa sa kanyang atomic numero, pagkatapos ito ay nagiging ayon sa pagkakabanggit negatibo o positibo sisingilin bilang isang kabuuan; may kargang atom ay tinatawag na isang ion. Mga electron ay kilala dahil sa ang huli ng ika-19 na siglo, halos salamat sa J. J. Thomson; tingnan ang kasaysayan ng mga subatomic physics para sa mga detalye.
Protons magkaroon ng isang positibong singil at isang mass 1,836 beses na ng mga elektron, sa 1.6726×10-27 kg. Ang bilang ng mga protons sa isang atom ay tinatawag na nito atomic numero. Ernest Rutherford (1919) - obserbahan na ang nitrogen sa ilalim ng alpha-maliit na butil panganganyon ejects kung ano ang lumitaw na maging hydrogen nuclei. Sa pamamagitan ng 1920 siya ay tinanggap na ang hydrogen nucleus ay isang natatanging maliit na butil sa loob ng atom at pinangalanan ito proton.
Neutrons ay walang mga de-koryenteng singil at magkaroon ng isang libreng masa ng 1,839 beses sa masa ng elektron,[11] o 1.6929×10-27 kg, ang heaviest ng tatlong mga manghahalal mga particle, ngunit ito ay maaaring nabawasan sa pamamagitan ng ang nuclear umiiral na enerhiya. Neutrons at protons (sama-sama na kilala bilang nucleon) ay maihahambing na mga sukat—sa pagkakasunud-sunod ng 2.5×10-15 m—kahit na ang mga 'ibabaw' ng mga particle ay hindi nang masakit na tinukoy.[12] Ang neutron ay natuklasan sa 1932 sa pamamagitan ng ang ingles pisisista James Chadwick.
Sa mga Standard na mga Modelo ng pisika, ang mga electron ay tunay elementarya particle na may walang mga panloob na istraktura. Gayunman, ang parehong mga protons at neutrons ay pinaghalong mga particle na binubuo ng elementarya particle na tinatawag na quarks. Mayroong dalawang mga uri ng mga quark sa atoms, ang bawat isa sa pagkakaroon ng isang fractional electric singil. Protons ay binubuo ng dalawang up quark (bawat isa ay may bayad +2/3) at isa down na quark (na may isang singil ng −1/3). Neutrons binubuo ng isa hanggang quark at down na dalawang quarks. Pagkakaiba na ito mga account para sa mga pagkakaiba sa masa at singil sa pagitan ng dalawang mga particle.
Ang quark ay gaganapin sama-sama sa pamamagitan ng ang malakas na pakikipag-ugnayan (o malakas na puwersa), na kung saan ay mediated sa pamamagitan ng gluon. Ang mga protons at neutrons, na sa turn, ay gaganapin sa bawat isa sa nucleus sa pamamagitan ng nuclear force, na kung saan ay isang latak ng malakas na puwersa na ay medyo iba ' t ibang hanay ng mga katangian (tingnan ang artikulo sa nuclear force para sa higit pang mga). Ang gluon ay isang miyembro ng pamilya ng mga gauge boson, na kung saan ay elementarya particle na pumagitna ang pisikal na pwersa.
Nucleus
[baguhin | baguhin ang wikitext]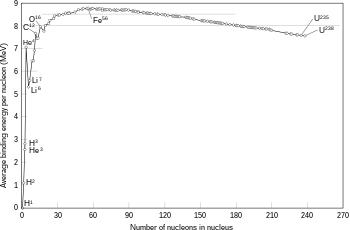
Ang lahat ng mga tinali protons at neutrons sa isang atom gumawa ng up ng isang maliit na atomic nucleus, at sama-sama na tinatawag na nucleon. Ang radius ng isang nucleus ay humigit-kumulang sa pantay-pantay sa 1.07 3√ang Isang fm, kung saan ang Isang ay ang kabuuang bilang ng mga nucleon.[13] Ito ay mas maliit kaysa sa ang radius ng ang atom, na kung saan ay sa pagkakasunud-sunod ng 105 fm. Ang nucleon ay nakatali magkasama sa pamamagitan ng isang short-ranged kaakit-akit sa mga potensyal na tinatawag na ang mga natitirang malakas na puwersa. Sa distansya na mas maliit kaysa sa 2.5 fm puwersa na ito ay magkano ang mas malakas kaysa sa electrostatic lakas na nagiging sanhi ng positibo sisingilin protons upang maitaboy sa bawat isa.[14]
Mga Atoms ng parehong elemento ay ang parehong bilang ng mga protons, na tinatawag na ang atomic numero. Sa loob ng isang solong elemento, ang bilang ng neutron ay maaaring mag-iba, sa pagtukoy ng mga isotopo ng na elemento. Ang kabuuang bilang ng mga protons at neutrons matukoy ang nabuo ang canao. Ang bilang ng neutron kamag-anak upang ang mga protons na tumutukoy sa katatagan ng nucleus, na may ilang mga isotopes sumasailalim sa radioactive pagkabulok.
Ang proton, ang mga elektron, at ang neutron ay naiuri bilang mga fermion. Fermion sundin ang Pauli exclusion prinsipyo na kung saan ipinagbabawal ang mga magkakahawig na mga fermion, tulad ng maramihang mga protons, na sumasakop mula sa parehong kabuuan ng estado sa parehong oras. Kaya, ang bawat proton sa nukleyo ay dapat maghawak ng isang kabuuan ng estado ng iba ' t-ibang mula sa lahat ng iba pang mga protons, at ang parehong nalalapat sa lahat ng mga neutrons ng nucleus at sa lahat ng mga electron sa ulap ng elektron.
Para sa mga atomo na may mababang atomic numero, isang nucleus na may higit pang mga neutrons kaysa protons ay may gawi na i-drop sa isang mas mababang estado ng enerhiya sa pamamagitan ng radioactive pagkabulok kaya na ang neutron–proton ratio ay mas malapit sa isa. Gayunpaman, bilang ang atomic numero ng pagtaas, ang isang mas mataas na proporsyon ng mga neutrons ay kinakailangan upang i-offset ang mga mutual na pagkasuklam ng protons. Kaya, doon ay walang matatag na nuclei na may pantay na mga proton at neutron mga numero sa itaas ng atomic numero ng Z = 20 (kaltsyum) at bilang Z ay nagdaragdag, ang mga neutron–proton ratio ng matatag isotopes ay nagdaragdag.[wala sa ibinigay na pagbabanggit] Ang matatag isotope na may pinakamataas na proton–neutron ratio ay humantong-208 (tungkol sa 1.5).
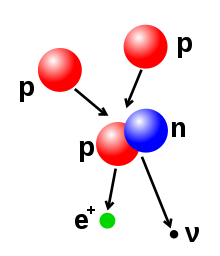
Ang bilang ng mga protons at neutrons sa atomic nucleus ay maaaring mabago, kahit na ito ay nangangailangan ng napaka-mataas na energies dahil sa malakas na puwersa. Nuclear fusion ay nangyayari kapag ang maramihang mga atomic particle na sumali sa form ng isang mabigat na nucleus, tulad ng sa pamamagitan ng energetic banggaan ng dalawang nuclei. Halimbawa, sa core ng Araw protons nangangailangan ng mga energies ng 3-10 keV upang pagtagumpayan ang kanilang mga mutual na pagkasuklam—ng coulomb barrier—at piyus magkasama sa isang solong nucleus. Nuclear fission ay ang kabaligtaran proseso, na nagiging sanhi ng isang nucleus upang hatiin sa dalawang mas maliit na nuclei—karaniwang sa pamamagitan ng radioactive pagkabulok. Ang nucleus ay maaari ring mabago sa pamamagitan ng panganganyon sa pamamagitan ng mataas na enerhiya na mga subatomic particle o photon. Kung ito binabago ang bilang ng proton sa nukleyo ng atomo ng mga pagbabago sa isang iba ' t ibang mga kemikal na elemento.
Kung ang mga masa ng nucleus mga sumusunod na ng isang pagsasanib reaksyon ay mas mababa kaysa sa kabuuan ng mga masa ng mga hiwalay na mga particle, at pagkatapos ay ang pagkakaiba sa pagitan ng dalawang mga halaga ay maaaring maging napalabas bilang isang uri ng mga kapaki-pakinabang na enerhiya (tulad ng gamma ray, o ang kinetiko enerhiya ng isang beta maliit na butil), tulad ng inilarawan sa pamamagitan ng Albert Einstein's pagkakatumbas na masa–enerhiya na formula, ang E = mc2, kung saan m ay ang masa ng timbang at c ay ang bilis ng liwanag. Depisit na ito ay bahagi ng umiiral na enerhiya ng bagong nucleus, at ito ay ang di-makuha pagkawala ng enerhiya na nagiging sanhi ng mga fused mga particle upang manatili nang sama-sama sa isang estado na ito ay nangangailangan ng enerhiya upang paghiwalayin.[15]
Ang pagsasanib ng dalawang nuclei na lumikha ng mas malaking mga nuclei na may mas mababang mga atomic numero kaysa sa iron at nickel—ng isang kabuuang nucleon bilang ng mga tungkol sa 60—ay karaniwang isang exothermic proseso na release ng mas maraming enerhiya kaysa ay kinakailangan upang dalhin ang mga ito sama-sama. ang mga Ito ay ang enerhiya na ilalabas ang proseso na gumagawa ng nuclear fusion sa mga bituin ng isang self-nagtutukod reaksyon. Para sa mas mabigat na nuclei, ang mga umiiral na enerhiya sa bawat nucleon sa nucleus ay nagsisimula upang bawasan. Iyon ay nangangahulugang ang pagsasanib ng mga proseso ng paggawa ng mga nuclei na magkaroon ng atomic numero ng mas mataas kaysa sa tungkol sa 26, at atomic masa na mas mataas kaysa sa tungkol sa 60, ay isang kontinental proseso. Ang mga mas malaki nuclei ay hindi maaaring sumailalim sa isang enerhiya-paggawa ng pagsasanib reaksyon na maaaring sang-ayunan ang hydrostatic punto ng balanse ng isang bituin.
Ulap ng elektron
[baguhin | baguhin ang wikitext]
Ang mga elektron sa isang atomo ay naaakit sa mga proton sa nukleyo sa pamamagitan ng elektromagnetismo. Ang puwersa na binds ang mga elektron sa loob ng isang electrostatic potensyal na rin ang mga nakapalibot na ang mga mas maliit na mga nukleyus, na kung saan ay nangangahulugan na ang isang panlabas na pinagmulan ng enerhiya ay kinakailangan para sa ang mga elektron upang makatakas. Ang mas malapit sa isang elektron ay upang ang nucleus, ang mas malaki ang kaakit-akit na puwersa. Samakatuwid electron nakatali malapit sa sentro ng ang mga potensyal na rin ang nangangailangan ng mas maraming enerhiya upang makatakas kaysa sa mga sa mas mataas na mga separations.
Mga electron, tulad ng iba pang mga particle, magkaroon ng mga katangian ng parehong isang maliit na butil at ang isang alon. Ang mga ulap ng elektron ay isang rehiyon sa loob ng mga potensyal na rin kung saan ang bawat elektron mga form ng isang uri ng tatlong-dimensional na nakatayo wave—wave form na ay hindi ilipat ang mga kamag-anak upang ang nucleus. Pag-uugali na ito ay tinukoy sa pamamagitan ng isang atomic orbital, isang mathematical function na characterizes ang posibilidad na ang isang elektron ay lilitaw upang maging sa isang partikular na lokasyon kapag ang posisyon nito ay sinusukat. Lamang ng isang hiwalay (o mga anak) set ng mga bansa na umiiral sa palibot ng nucleus, bilang ng iba pang mga posibleng mga pattern ng wave mabilis na pagkabulok sa isang mas matatag na form. para sa Bansa ay maaaring magkaroon ng isa o higit pang mga singsing o node kaayusan, at naiiba mula sa bawat isa sa sukat, hugis at orientation.

Ang bawat atomic orbital ay tumutugon sa isang partikular na antas ng enerhiya ng elektron. Ang elektron ay maaaring baguhin ang kanyang estado sa isang mas mataas na antas ng enerhiya sa pamamagitan ng lubhang kaganyak-ganyak ng isang poton na may sapat na enerhiya upang mapalakas ang mga ito sa bagong quantum estado. Gayon din naman, sa pamamagitan ng kusang-loob na pagpapalabas, ang isang elektron sa isang mas mataas na estado ng enerhiya ay maaaring i-drop sa isang mas mababang estado ng enerhiya habang radiate ang labis na enerhiya bilang isang poton. Ang mga katangian na enerhiya na mga halaga, na tinukoy sa pamamagitan ng ang pagkakaiba sa ang mga energies ng quantum unidos, ay responsable para sa atomic parang multo linya.
Ang halaga ng enerhiya na kinakailangan upang alisin o magdagdag ng isang elektron—ang elektron umiiral na enerhiya—ay malayo mas mababa kaysa sa umiiral na enerhiya ng nucleon. Para sa halimbawa, ito ay nangangailangan lamang ng 13.6 eV upang i-strip ng lupa-estado elektron mula sa isang hydrogen atom, kumpara sa 2.23 milyong eV para sa paghahati ng isang deuterium nucleus. Atoms ay electrically neutral na kung mayroon sila ng isang patas na bilang ng mga protons at electron. Atoms na magkaroon ng alinman sa isang kakulangan o kalabisan ng mga electron ay tinatawag na mga ions. Mga electron na ay pinakamalayo mula sa nucleus ay maaaring ilipat sa iba pang mga kalapit na atoms o ibinahagi sa pagitan ng mga atoms. Sa pamamagitan ng mekanismong ito, ang mga atoms ay magagawang upang bono sa molecules at iba pang mga uri ng compounds kemikal tulad ng ionic at ibang mga network ng mga kristal.[16]
Mga katangian
[baguhin | baguhin ang wikitext]Nuclear katangian
[baguhin | baguhin ang wikitext]Sa pamamagitan ng kahulugan, ang anumang dalawang mga atoms sa isang magkatulad na bilang ng mga protons sa kanilang nuclei na nabibilang sa parehong mga kemikal na elemento. Atoms na may pantay na bilang ng mga protons ngunit sa isang iba 't ibang mga bilang ng neutron ay iba' t ibang mga isotopes ng parehong mga elemento. Halimbawa, ang lahat ng mga atoms ng hydrogen umamin eksaktong isang proton, ngunit isotopes umiiral sa walang neutron (hydrogen-1, sa pamamagitan ng malayo ang pinaka-karaniwang mga form, tinatawag din na protium), isang neutron (deuterium), dalawang neutrons (tritiyum) at higit sa dalawang neutrons. Ang mga elemento na kilala form ng isang hanay ng mga atomic numero, mula sa ang proton elemento ng hydrogen hanggang sa 118-proton elemento oganesson. ang Lahat ng mga kilalang mga isotopo ng mga elemento na may atomic numero ng mas malaki kaysa sa 82 ay radioactive, kahit na ang radyaktibidad ng mga elemento 83 (bismuth) ay kaya bahagyang bilang upang maging kapaki-pakinabang na paraan bale-wala.[17]
Tungkol sa 339 nuclides mangyari nang natural sa Lupa, ng kung saan 254 (tungkol sa 75%) ay hindi nai-obserbahan sa pagkabulok, at ito ay tinutukoy bilang "matatag isotopes". Gayunpaman, lamang ng 90 ng mga nuclides ay matatag sa lahat ng pagkabulok, kahit na sa teorya. Isa pang 164 (nagdadala ang kabuuang sa 254) ay hindi nai-obserbahan sa pagkabulok, kahit na sa teorya ito ay energetically ' t maaari. Ang mga ito ay pormal na ring nabansagang "matatag". Isang karagdagang 34 radioactive nuclides magkaroon ng kalahati-buhay ng mas mahaba kaysa sa 80 milyong taon, at pang-nanirahan sapat upang maging kasalukuyan mula sa kapanganakan ng solar system. Ang koleksyon na ito ng 288 nuclides ay kilala bilang mula sa simula nuclides. Sa wakas, ang isang karagdagang 51 maikling-nanirahan nuclides ay kilala na mangyari sa natural na, tulad ng anak na babae ng mga produkto ng mula sa simula nabuo ang canao pagkabulok (tulad ng radyum mula sa uranium), o iba pa bilang mga produkto ng natural na masipag proseso sa Lupa, tulad ng cosmic ray na panganganyon (halimbawa, carbon-14).[note 1]
Para sa 80 ng mga elemento ng kemikal, ng hindi bababa sa isang matatag isotope umiiral. Bilang isang panuntunan, doon ay lamang ng isang maliit na bilang ng mga matatag isotopes para sa bawat isa ng ang mga elemento, ang average na pagiging 3.2 matatag isotopes sa bawat elemento. Dalawampu ' t-anim na mga elemento na may lamang ng isang solong matatag isotope, habang ang pinakamalaking bilang ng mga matatag isotopes sinusunod para sa anumang elemento ay sampung, para sa ang mga elemento na gawa sa lata. Mga elemento 43, 61, at ang lahat ng mga elemento bilang 83 o mas mataas ay walang matatag isotopes.[18][Pahina'y kailangan]
Katatagan ng mga isotopo ay apektado sa pamamagitan ng ang ratio ng mga protons upang neutrons, at din sa pamamagitan ng pagkakaroon ng ilang mga "magic numero" ng mga neutrons o protons na kumakatawan sa sarado at puno ng quantum shell. Ang mga quantum shell ay tumutugma sa isang hanay ng mga antas ng enerhiya sa loob ng shell modelo ng nucleus; na puno ng mga shell, tulad ng mga puno ng mga shell ng 50 protons para sa tin, isinasangguni hindi pangkaraniwang katatagan sa nabuo ang canao. Ng 254 kilala matatag nuclides, tanging ang apat na magkaroon ng parehong isang kakaiba bilang ng mga protons at kakaiba bilang ng neutron: hydrogen-2 (deuterium), lithium-6, boron-10 at nitrogen-14. Gayundin, tanging ang apat na natural na nagaganap, radioactive kakaibang–kakaiba nuclides magkaroon ng isang kalahati-buhay ng higit sa isang bilyong taon: potasa-40, vanadium-50, lanthanum-138 at tantalum-180m. Pinaka-kakaibang–kakaiba nuclei ay lubos na pabagu-bago na may paggalang sa beta pagkabulok, dahil ang mga produkto ng pagkabulok ay kahit na–kahit na, at samakatuwid ay higit na matindi ang nakasalalay, dahil sa nuclear pagpapares ng mga epekto.[Pahina'y kailangan]
Masa
[baguhin | baguhin ang wikitext]Ang malaking karamihan ng isang atom masa ay mula sa mga protons at neutrons na gumawa ng up ang mga ito. Ang kabuuang bilang ng mga particle (na tinatawag na "nucleon") sa isang atomo ay tinatawag na ang masa bilang. Ito ay isang positibong integer at dimensionless (sa halip ng pagkakaroon ng sukat ng masa), dahil ito ay nagpapahayag ng isang count. Isang halimbawa ng paggamit ng isang masa bilang na ito ay "carbon-12," kung saan ay may 12 nucleon (anim na protons at anim na neutron).
Ang aktwal na masa ng isang atom sa natitirang bahagi ay madalas na ipinahayag sa paggamit ng pinag-isang atomic mass unit (u), tinatawag din na dalton (Da). Ang yunit na ito ay tinukoy bilang isang ikalabindalawa ng masa ng isang libreng neutral na atomo ng carbon-12, na kung saan ay humigit-kumulang 1.66×10-27 kg. Hydrogen-1 (ang lightest na isotope ng hydrogen na kung saan ay din ang nabuo ang canao na may pinakamababang mass) ay isang atomic timbang ng 1.007825 u. Ang halaga ng ang bilang na ito ay tinatawag na ang atomic mass. Isang atomo ay isang atomic mass humigit-kumulang sa pantay-pantay (sa loob ng 1%) nito sa masa bilang ng mga oras atomic mass unit (halimbawa ang masa ng isang nitrogen-14 ay halos 14 u). Gayunpaman, ang bilang na ito ay hindi eksakto ng isang integer maliban sa kaso ng karbon-12 (tingnan sa ibaba). Ang heaviest matatag atom ay humantong-208, sa isang masa ng mga 207.9766521 u.
Tulad ng kahit na ang pinaka-napakalaking mga atoms ay malayo masyadong liwanag upang gumana sa direkta, chemists sa halip na gamitin ang mga yunit ng mga moles. Isa taling ng mga atoms ng anumang elemento ay palaging ang parehong bilang ng mga atoms (tungkol sa 6.022×1023). Ang bilang na ito ay pinili sa gayon kung ang isang elemento ay may isang atomic masa ng 1 u, isang taling ng mga atomo ng na elemento ay may isang mass malapit sa isa gramo. Dahil sa ang kahulugan ng pinag-isang atomic mass yunit, ang bawat carbon-12 atom ay may isang atomic masa ng eksaktong 12 u, at sa gayon ang isang taling ng carbon-12 atoms weighs eksakto 0.012 kg.[19]
Hugis at laki
[baguhin | baguhin ang wikitext]Atoms kakulangan ng isang well-natukoy na mga panlabas na hangganan, kaya ang kanilang mga sukat ay karaniwang inilarawan sa mga tuntunin ng isang atomic radius. Ito ay isang sukatan ng ang layo out sa kung saan ang mga ulap ng elektron ay umaabot mula sa nucleus.[20] Gayunpaman, ito ipinagpapalagay ang atom upang magpakita ng isang pabilog na hugis, na kung saan ay sinunod lamang para sa mga atoms sa vacuum o libreng espasyo. Atomic radii ay maaaring nagmula mula sa ang distansya sa pagitan ng dalawang nuclei kapag ang dalawang mga atoms ay sumali sa isang kemikal na bono. Ang radius ay nag-iiba sa ang lokasyon ng isang atom sa atomic tsart, ang uri ng mga kemikal na bono, ang bilang ng mga kalapit na atoms (koordinasyon number) at isang kwantum mekaniks ng ari-arian na kilala bilang iikot. Sa periodic table ng mga elemento, atom laki tends upang madagdagan kapag gumagalaw down na mga haligi, ngunit bumaba kapag gumagalaw sa kabuuan ng mga hilera (kaliwa pakanan). Dahil dito, ang pinakamaliit na atom ng helium ay may isang radius ng 32 pm, habang ang isa ng ang pinakamalaking ay tsesiyum sa 225 pm.[21]
Kapag sumailalim sa panlabas na pwersa, tulad ng mga de-koryenteng mga patlang, ang hugis ng isang atom ay maaaring mag-iba mula sa spherical mahusay na proporsyon. Ang pagpapapangit ay depende sa ang field ng magnitude at ang orbital uri ng mga panlabas na shell electron, tulad ng ipinapakita sa pamamagitan ng mga grupo ng-panteorya pagsasaalang-alang. Aspherical deviations maaaring elicited halimbawa sa mga kristal, kung saan ang malaking kristal-mga de-koryenteng mga patlang ay maaaring mangyari sa mga mababang-mahusay na proporsyon sala-sala site.[22][23] Makabuluhang ellipsoidal deformations ay nai-ipinapakita upang mangyari para sa kulay ng asupre ions[24] at chalcogen ions[25] sa pyrite-uri ng compounds.
Atomic sukat ay isang libong beses na mas maliit kaysa sa ang mga wavelength ng liwanag (400-700 nm) kaya hindi sila maaaring matingnan gamit ang isang optical mikroskopyo. Gayunpaman, ang mga indibidwal na mga atoms ay maaaring obserbahan ang paggamit ng isang pag-scan ng tunneling mikroskopyo. Upang maisalarawan ang minuteness ng ang atom, isaalang-alang na ang isang tipikal na tao buhok ay tungkol sa 1 milyong mga carbon atoms sa lapad. ang Isang solong drop ng tubig ay naglalaman ng tungkol sa 2 sextillion (2×1021) atomo ng oksiheno, at dalawang beses ang bilang ng mga atoms ng hydrogen.[26] ang Isang solong karat diamond na may isang masa ng 2×10-4 kg naglalaman ng tungkol sa 10 sextillion (1022) atomo ng carbon.[note 2] Kung ang isang mansanas ay pinalaking sa laki ng Earth, pagkatapos ay ang mga atoms sa apple ay magiging humigit-kumulang ang laki ng orihinal na apple.[27]
Radioactive pagkabulok
[baguhin | baguhin ang wikitext]
Ang bawat elemento ay may isa o higit pang mga isotopes na magkaroon ng mga hindi matatag na nuclei na ay napapailalim sa radioactive pagkabulok, na nagiging sanhi ng nucleus na naglalabas ng mga particle o electromagnetic radiation. Radyaktibidad ay maaaring mangyari kapag ang radius ng isang nucleus ay malaki kumpara sa ang radius ng malakas na puwersa, na kung saan gawa lamang sa paglipas ng mga distansya sa pagkakasunud-sunod ng 1 fm.
Ang pinaka-karaniwang paraan ng radioactive pagkabulok ay ang mga:[28]
- Alpha pagkabulok: ang prosesong ito ay sanhi kapag ang nucleus emits isang alpha maliit na butil, na kung saan ay isang tunugang mayor na binubuo ng dalawang protons at dalawang neutrons. Ang resulta ng pagpapalabas ay isang bagong sangkap na may isang mas mababang bilang atomiko.
- Beta pagkabulok (at elektron makuha): ang mga proseso ay kinokontrol sa pamamagitan ng ang mahina ang puwersa, at mga resulta mula sa isang pag-iibang-anyo ng isang neutron sa isang proton, o ng isang proton sa isang neutron. Ang neutron sa proton paglipat ay sinamahan sa pamamagitan ng pagpapalabas ng isang elektron at ang isang neutrino, habang proton sa neutron paglipat (maliban sa elektron makuha) nagiging sanhi ng pagpapalabas ng isang positron at isang neutrino. Ang mga elektron o positron emissions ay tinatawag na beta na mga particle. Beta pagkabulok alinman nadadagdagan o nababawasan ang atomic numero ng nucleus sa pamamagitan ng isa. Elektron makuha ay mas karaniwan kaysa sa positron pagpapalabas, dahil ito ay nangangailangan ng mas kaunting enerhiya. Sa ganitong uri ng pagkabulok, ang isang elektron ay buyo sa pamamagitan ng ang nucleus, sa halip na isang positron ibinubuga mula sa nucleus. Isang neutrino ay pa rin ipinapalabas sa ang proseso na ito, at isang proton ng mga pagbabago sa isang neutron.
- Gamma pagkabulok: ang mga resulta ng proseso mula sa isang pagbabago sa mga antas ng enerhiya ng nucleus sa isang mas mababang estado, na nagreresulta sa ang pagpapalabas ng electromagnetic radiation. Ang nasasabik estado ng isang nucleus kung saan ang mga resulta sa gamma pagpapalabas ng mga karaniwang nangyayari sa mga sumusunod ang pagpapalabas ng isang alpha o beta maliit na butil. Kaya, gamma pagkabulok karaniwang sumusunod alpha o beta pagkabulok.
Iba pang mga higit pang mga bihirang mga uri ng radioactive pagkabulok isama ang pagbuga ng neutrons o protons o kumpol ng mga nucleon mula sa nucleus, o higit sa isang beta maliit na butil. Isang analog ng gamma pagpapalabas na kung saan ay nagbibigay-daan nasasabik nuclei upang mawalan ng enerhiya sa isang iba ' t ibang paraan, ay mga panloob na mga conversion—isang proseso na gumagawa ng mataas na-bilis ng mga electron na hindi beta ray, na sinundan sa pamamagitan ng produksyon ng mga mataas na enerhiya na mga photons na hindi gamma ray. Ang ilang mga malalaking nuclei sumabog sa dalawa o higit pang mga sinisingil ng mga fragment ng iba ' t ibang mga masa plus ilang mga neutrons, sa isang pagkabulok tinatawag na kusang-loob nuclear fission.
Ang bawat radioactive isotope ay isang katangian ng pagkabulok na tagal ng panahon—ang kalahati-buhay—na ay natutukoy sa pamamagitan ng ang halaga ng oras na kinakailangan para sa kalahati ng isang sample sa pagkabulok. Ito ay isang exponential decay proseso na patuloy na bumababa ang bahagdan ng ang mga natitirang mga isotopo sa pamamagitan ng 50% sa bawat kalahating-buhay. Kaya pagkatapos ng dalawang kalahating-buhay ay lumipas lamang ng 25% ng mga isotopo ay naroroon, at iba pa.
Magnetic sandali
[baguhin | baguhin ang wikitext]Elementarya particle nagtataglay ng isang tunay na kwantum mekaniks ng ari-arian na kilala bilang iikot. Ito ay kahalintulad sa angular momentum ng isang bagay na ay umiikot sa paligid nito sa gitna ng masa, kahit na mahigpit na nagsasalita ang mga particle ay pinaniniwalaan na point-tulad ng at hindi maaaring sinabi na maging umiikot. Iikot ay sinusukat sa mga yunit ng nabawasan Planck pare-pareho (ħ), na may mga elektron, proton at neutron ang lahat ng pagkakaroon ng iikot ½ ħ, o "spin-½". Sa isang atom, paggalaw ng mga electron sa palibot ng nucleus nagtataglay ng orbital angular momentum sa karagdagan sa kanilang mga paikutin, habang ang nucleus mismo ay nagtataglay ng angular momentum dahil sa kanyang nuclear iikot.
Ang magnetic field na ginawa sa pamamagitan ng isang atom—kanyang magnetic sandali—ay natutukoy sa pamamagitan ng mga iba ' t-ibang mga paraan ng angular momentum, lamang bilang isang umiikot na mga bagay na sisingilin classical na gumagawa ng isang magnetic field. Gayunman, ang pinaka-nangingibabaw na kontribusyon ay mula sa elektron magsulid. Dahil sa likas na katangian ng mga electron upang sundin ang Pauli exclusion prinsipyo, kung saan walang mga dalawang mga electron ay maaaring maging natagpuan sa parehong kabuuan ng estado, tinali electron pair up sa bawat isa, na may isang miyembro ng bawat pares sa isang magsulid-up ng estado at ang iba pang sa tapat, iikot down na estado. Kaya ang mga spins kanselahin ang bawat isa out, pagbabawas ng kabuuang magnetic dipole sandali sa zero sa ilang mga atoms na may kahit na bilang ng mga electron.
Sa ferromagnetic mga sangkap tulad ng bakal, kobalt at magtubog sa nikel, isang kakaiba bilang ng mga electron ay humahantong sa isang unpaired elektron at ang isang pangkalahatang net magnetic sandali. Ang orbitals ng mga kalapit na atoms overlap at ng isang mas mababang enerhiya estado ay nakakamit kapag ang spin ng unpaired mga electron ay nakahanay sa bawat iba pang mga, sa isang kusang-loob na proseso na kilala bilang isang exchange ng pakikipag-ugnayan. Kapag ang magnetic sandali ng ferromagnetic atoms ay may linya up, ang mga materyal ay maaaring makabuo ng isang masusukat na mga macroscopic patlang. Paramagnetic mga materyales na magkaroon ng mga atomo na may magnetic sandali na linya up sa random na mga direksyon kapag walang magnetic field ay kasalukuyan, ngunit ang mga magnetic na mga sandali ng mga indibidwal na mga atoms linya up sa ang presensya ng isang patlang.
Ang nucleus ng isang atom ay walang iikot kapag ito ay kahit na mga numero ng parehong mga neutrons at protons, ngunit para sa iba pang mga kaso ng kakaiba mga numero, ang nucleus ay maaaring magkaroon ng isang iikot. Normal na nuclei na may iikot ay nakahanay sa random na mga direksyon dahil sa thermal punto ng balanse. Gayunpaman, para sa tiyak na mga elemento (tulad ng sa xenon-129) ito ay posible upang kalabanin ang isang makabuluhang bahagdan ng nuclear iikot unidos sa gayon na sila ay nakahanay sa parehong direksyon—isang kondisyon na tinatawag na hyperpolarization. Ito ay may mahalagang aplikasyon sa magnetic resonance imaging.[29]
Mga antas ng enerhiya
[baguhin | baguhin ang wikitext]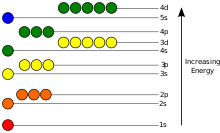
Ang mga potensyal na enerhiya ng isang elektron sa isang atomo ay negatibo, ang pag-asa ng kanyang posisyon umabot sa minimum na (ang pinaka - absolute value) sa loob ng nucleus, at vanishes kapag ang distansya mula sa nucleus papunta sa kawalang-hanggan, humigit-kumulang sa isang kabaligtaran proporsyon sa ang distansya. Sa quantum-mekanikal mga modelo, ang isang nakatali elektron ay maaari lamang sumasakop sa isang hanay ng mga unidos nakasentro sa nucleus, at ang bawat estado ay kumakatawan sa isang tiyak na antas ng enerhiya; tingnan ang oras-independent Schrödinger equation para sa panteorya paliwanag. Ang isang antas ng enerhiya ay maaaring sinusukat sa pamamagitan ng ang halaga ng enerhiya na kinakailangan upang kalagan ang mga elektron mula sa mga atom, at ay karaniwang ibinigay sa mga yunit ng electronvolts (eV). Ang pinakamababang estado ng enerhiya ng isang nakagapos elektron ay tinatawag na ang mga lupa ng estado, ibig sabihin nakapirme estado, habang ang isang elektron paglipat sa isang mas mataas na antas na mga resulta sa isang nasasabik estado. Ang mga elektron ay enerhiya itataas kapag n ay nagdaragdag dahil ang (average) distansya sa nukleyo. Pag-asa ng enerhiya sa ℓ ay sanhi ng hindi sa pamamagitan ng electrostatic mga potensyal na ng nucleus, ngunit sa pamamagitan ng pakikipag-ugnayan sa pagitan ng mga electron.
Para sa isang elektron sa paglipat sa pagitan ng dalawang mga iba ' t-ibang mga estado, hal grawnded estado sa unang nasasabik na antas (ionization), ito ay dapat na maunawaan o naglalabas ng isang poton sa isang enerhiya ng pagtutugma ng mga pagkakaiba sa ang mga potensyal na enerhiya ng ang mga antas, ayon sa Niels Bohr modelo, kung ano ang maaaring maging tiyak kinakalkula sa pamamagitan ng ang Schrödinger equation. Mga electron lumipat sa pagitan ng mga bansa sa isang maliit na butil-tulad ng fashion. Halimbawa, kung ang isang solong poton strike ang mga electron, lamang ng isang solong elektron pagbabago unidos bilang tugon sa poton; tingnan ang mga Elektron na mga katangian.
Ang enerhiya ng isang napalabas poton ay proporsyonal sa kanyang dalas, kaya ang mga tiyak na mga antas ng enerhiya lumitaw bilang natatanging band sa electromagnetic spectrum.[30] ang Bawat elemento ay may isang katangian na spectrum na maaaring nakasalalay sa mga nuclear bayad, subshells napuno sa pamamagitan ng mga electron, ang electromagnetic mga pakikipag-ugnayan sa pagitan ng mga electron at iba pang mga kadahilanan.

Kapag ang isang tuloy-tuloy na spectrum ng enerhiya ay pumasa sa pamamagitan ng isang gas o plasma, ang ilang mga ng mga photons ay buyo sa pamamagitan ng mga atoms, na nagiging sanhi ng mga electron upang baguhin ang kanilang mga antas ng enerhiya. Mga nasasabik electron na mananatiling nakasalalay sa kanilang mga atom spontaneously sa naglalabas ito ng enerhiya bilang isang poton, naglalakbay sa isang random na direksyon, at kaya i-drop pabalik sa mas mababang antas ng enerhiya. Kaya ang mga atoms kumilos na tulad ng isang filter na mga form ng isang serye ng mga madilim na pagsipsip ng mga banda sa enerhiya output. (Isang tagamasid sa pagtingin ng mga atoms mula sa isang view na ay hindi isama ang tuloy-tuloy na spectrum sa background, sa halip na nakikita ng isang serye ng pagpapalabas ng mga linya mula sa mga photons na ipinapalabas sa pamamagitan ng mga atoms.) Spectroscopic sukat ng lakas at lapad ng atomic parang multo linya payagan ang komposisyon at pisikal na katangian ng isang bagay na tinutukoy.
Malapit na pagsusuri ng mga parang multo linya ay ipinapakita na ang ilang mga display ng isang masarap na istraktura ng malakas. Ito ay nangyayari dahil sa spin–orbit pagkabit, na kung saan ay isang pakikipag-ugnayan sa pagitan ng mga spin at mga paggalaw ng ang pinakamalayo elektron. Kapag ang isang atom ay sa isang panlabas na magnetic field, parang multo ang mga linya maging hinati sa tatlong o higit pang mga bahagi; isang hindi pangkaraniwang bagay na tinatawag na ang Zeeman epekto. Ito ay sanhi ng pakikipag-ugnayan ng magnetic field gamit ang magnetic sandali ng atom at ang mga electron. Ang ilang mga atoms ay maaaring magkaroon ng maramihang mga elektron configuration na may parehong antas ng enerhiya, na kung saan sa gayon ay lumitaw bilang isang solong parang multo linya. Ang pakikipag-ugnayan ng magnetic field sa atom nagbabago ang mga elektron configuration sa bahagyang iba ' t ibang mga antas ng enerhiya, na nagreresulta sa maramihang mga parang multo linya. Ang pagkakaroon ng isang panlabas na de-kuryenteng mga patlang ay maaaring maging sanhi ng isang maihahambing na paghahati ng pang-at paglilipat ng mga parang multo linya sa pamamagitan ng pagbabago ang mga elektron na mga antas ng enerhiya, isang hindi pangkaraniwang bagay na tinatawag na ang Naninigas na epekto.[31]
Kung ang isang nakatali elektron ay sa isang nasasabik estado, ang isang pakikipag-ugnay poton ng tamang enerhiya ay maaaring maging sanhi ng stimulated sa pagpapalabas ng isang poton na may isang pagtutugma ng mga antas ng enerhiya. Para sa mga ito upang mangyari, ang mga elektron ay dapat drop sa isang mas mababang estado ng enerhiya na ay isang enerhiya pagkakaiba ng pagtutugma ng mga enerhiya ng pakikipag-ugnay poton. Ang napalabas photon at ang mga pakikipag-ugnayan poton pagkatapos ay ilipat off sa parallel at sa pagtutugma ng phases. Iyon ay, ang mga pattern ng wave ng dalawang photons ay naka-synchronize. Ang mga pisikal na ari-arian ay ginagamit upang gumawa ng laser, na kung saan ay maaaring magbigay ng isang maliwanag na sinag ng liwanag enerhiya sa isang makitid na frequency band.
Valence at bonding na pag-uugali
[baguhin | baguhin ang wikitext]Bumubuo sa bahaging lupa ay ang pagsasama-sama ng kapangyarihan ng isang elemento. Ito ay pantay-pantay sa bilang ng mga atoms ng hydrogen atom ay maaaring pagsamahin o humalili sa bumubuo ng mga compounds.[32] Ang pinakamalayo shell electron ng isang atom sa kanyang uncombined estado ay kilala bilang ang valence shell, at ang mga electron sa na shell ay tinatawag na valence electron. Ang bilang ng mga valence electron ay tumutukoy sa bonding pag-uugali sa iba pang mga atoms. Mga Atoms ay may posibilidad na chemically reaksyon sa bawat isa sa isang paraan na pumupuno (o walang lamang sasakyan) ang kanilang mga panlabas na valence shell. halimbawa, ang isang paglipat ng isang solong elektron sa pagitan ng mga atoms ay isang kapaki-pakinabang na mga pagtatantya para sa bonds na bumubuo sa pagitan ng mga atomo na may isang elektron higit pa kaysa sa isang puno ng mga shell, at iba pa na ay isa-elektron maikling ng isang buong shell, tulad ng nangyayari sa compound sosa klorido at iba pang mga kemikal ionic asing-gamot. Gayunpaman, maraming mga elemento ipakita ang maramihang mga valences, o tendencies upang ibahagi ang mga magkakaibang bilang ng mga electron sa iba ' t ibang mga compounds. Kaya, chemical bonding sa pagitan ng mga sangkap na ito ay tumatagal ng maraming mga paraan ng elektron-pagbabahagi na ay higit pa kaysa sa mga simpleng paglipat ng elektron. Mga halimbawa isama ang mga elemento ng carbon at ang mga organic compounds.
Ang mga kemikal na sangkap ay madalas na ipinapakita sa isang periodic table na ay inilatag out upang ipakita ang mga umuulit na mga katangian ng kemikal, at mga elemento na may parehong bilang ng mga valence electron bumuo ng isang pangkat na ay nakahanay sa parehong hanay ng talahanayan. (Ang mga pahalang na mga hilera na tumutugma sa ang pagpuno ng isang quantum shell ng mga electron.) Ang mga elemento sa dulong kanan ng talahanayan na may ang kanilang mga panlabas na shell ng ganap na puno ng mga electron, kung saan ang mga resulta sa chemically hindi gumagalaw na mga elemento na kilala bilang ang marangal na gas.
Unidos
[baguhin | baguhin ang wikitext]
Dami ng mga atoms ay matatagpuan sa iba ' t-ibang mga estado ng matter na nakasalalay sa mga pisikal na mga kondisyon, tulad ng temperatura at presyon. Sa pamamagitan ng iba ' t ibang mga kundisyon, mga materyales ay maaaring paglipat sa pagitan ng mga solido, likido, mga gas at plasmas.[33] sa Loob ng isang estado, ang isang materyal na maaaring umiiral din sa iba ' t ibang mga allotropes. Isang halimbawa ng ito ay ang solid na carbon, na kung saan ay maaaring umiiral bilang grapayt o diamond. sa mga puno ng Gas allotropes umiiral pati na rin, tulad ng dioxygen at osono.
Sa mga temperatura na malapit sa absolute zero, ang mga atoms ay maaaring bumuo ng isang Bose–Einstein condensate, at sa puntong quantum mechanical effects, na kung saan ay normal lamang sinusunod sa atomic scale, maging maliwanag sa isang macroscopic scale.[34] Ang super-cooled koleksyon ng mga atoms pagkatapos ay behaves bilang isang solong super atom, na kung saan ay maaaring payagan ang mga pangunahing mga tseke ng kwantum mekaniks ng pag-uugali.
Pagkakakilanlan
[baguhin | baguhin ang wikitext]
Ang pag-scan ng tunneling mikroskopyo ay isang aparato para sa pagtingin sa ibabaw sa ang atomic antas. Gumagamit ito ng mga quantum tunneling hindi pangkaraniwang bagay, na kung saan ay nagbibigay-daan sa mga particle upang pumasa sa pamamagitan ng isang barrier na ay normal ay hindi malulutas. Mga electron ng lagusan sa pamamagitan ng vacuum sa pagitan ng dalawang mga planar metal electrodes, sa bawat isa sa kung saan ay isang adsorbed atom, na nagbibigay ng isang tunneling-kasalukuyang density na maaaring sinusukat. Pag-scan ng isang atomo (kinuha bilang ang mga tip) bilang ito gumagalaw nakalipas na ang iba pang mga (sample) ng mga pahintulot paglalagay ng mga tip sa pag-aalis laban sa pag-ilid paghihiwalay para sa isang pare-pareho ang kasalukuyang. Ang pagkalkula ay nagpapakita ng lawak na kung saan ang pag-scan-tunneling-mikroskopyo ng mga imahe ng isang indibidwal atom ay makikita. Ito kinukumpirma na para sa mababang bias, ang mikroskopyo ng mga imahe sa ang space-na-average na sukat ng mga elektron sa bansa sa kabuuan malapit na naka-pack na mga antas ng enerhiya—ang mga Fermi antas lokal na density ng estado.
Isang atom ay maaaring maging ionized sa pamamagitan ng pag-aalis ng isa sa kanyang mga electron. Ang electric singil nagiging sanhi ng ang tilapon ng isang atom upang yumuko kapag ito ay ipinapasa sa pamamagitan ng isang magnetic field. Ang radius sa pamamagitan ng kung saan ang tilapon ng isang paglipat ng ion ay naka-sa pamamagitan ng magnetic field ay natutukoy sa pamamagitan ng ang masa ng ang atom. Ang masa spektrometer ay gumagamit ng prinsipyo na ito upang sukatin ang masa-sa-singilin ang ratio ng mga ions. Kung ang isang sample na naglalaman ng maramihang mga isotopes, ang masa spektrometer ay maaaring matukoy ang bahagdan ng bawat isotopo sa sample sa pamamagitan ng pagsukat ng intensity ng iba ' t ibang mga beams ng mga ions. Mga diskarte upang gawing usok atoms isama inductively kaisa plasma atomic pagpapalabas espektroskopya at inductively kaisa plasma mass espektroskopya, na parehong gumamit ng isang plasma upang gawing usok ang mga sample para sa pag-aaral.
Isang higit pang mga lugar-pumipili pamamaraan ay elektron enerhiya pagkawala espektroskopya, na kung saan sinusukat ang enerhiya pagkawala ng isang elektron beam sa loob ng isang transmisyon elektron mikroskopyo kapag nakikipag-ugnayan ito sa isang bahagi ng isang sample. Ang atom-probe tomograpo ay sub-nanometer resolution sa 3-D at chemically makilala ang mga indibidwal na mga atoms gamit ang time-of-flight mass espektroskopya.
Spectra ng nasasabik estado ay maaaring magamit upang pag-aralan ang atomic komposisyon ng malayong mga bituin. Tiyak na liwanag wavelength na nakapaloob sa na-obserbahan ng ilaw mula sa mga bituin ay maaaring maging separated out at na may kaugnayan sa ang mga anak ng mga transition sa libreng gas atoms. Ang mga kulay ay maaaring kinokopya sa paggamit ng isang gas-discharge lampara na naglalaman ng parehong mga elemento. Helium ay natuklasan sa ganitong paraan sa ang spectrum ng Araw sa 23 taon bago ito ay natagpuan sa Lupa.
Pinagmulan at kasalukuyang estado
[baguhin | baguhin ang wikitext]Atoms form ng tungkol sa 4% ng ang kabuuang enerhiya density ng ang kapansin-pansin Uniberso, na may isang average density ng tungkol sa 0.25 atoms/m3. sa Loob ng isang kalawakan tulad ng ang Milky Way, atoms ay may isang mas mataas na konsentrasyon, sa density ng mga bagay na ito sa interstellar medium (TURO) mula sa 105 sa 109 atoms/m3.[35] Ang Araw ay pinaniniwalaan na maging sa loob ng Lokal na Bubble, isang rehiyon ng mataas na ionized gas, kaya ang density sa solar kapitbahayan ay lamang tungkol sa 103 atoms/m3. ang mga Bituin form mula sa siksik na ulap sa TURO, at ang sa gitna ng ebolusyon proseso ng mga bituin resulta sa matatag na pagpayaman ng TURO may mga elemento na mas malaki kaysa sa hydrogen at helium. Hanggang sa 95% ng ang Milky Way ay atoms ay puro sa loob ang mga bituin at ang kabuuang masa ng mga atoms na bumubuo sa tungkol sa 10% ng mass ng kalawakan.[36] (Ang natitirang bahagi ng masa ay isang hindi kilalang madilim na bagay na ito.)
Pagbuo
[baguhin | baguhin ang wikitext]Ang mga electron ay naisip na umiiral sa Uniberso dahil ang unang bahagi ng yugto ng Big Bang. Atomic nuclei ng mga form sa kabataan reaksyon. Sa tungkol sa tatlong minuto Big Bang kabataan na ginawa ang karamihan ng helium, lithium, at deuterium sa Uniberso, at marahil na ang ilang mga ng beryllium at boron.
Ubiquitousness at katatagan ng mga atoms ay umaasa sa kanilang mga umiiral na enerhiya, na kung saan ay nangangahulugan na ang isang atom ay may isang mas mababang enerhiya kaysa sa isang walang tali sistema ng nucleus at electrons. Kung saan ang temperatura ay mas mataas kaysa sa ionization mga potensyal na, ang mga bagay na umiiral sa anyo ng plasma—isang gas ng positibo sisingilin ions (marahil, walang kalaman-laman nuclei) at mga electron. Kapag ang temperatura ng patak sa ibaba ang ionization ng mga potensyal na, atoms maging istatistika kanais-nais. Atoms (kumpleto sa mga tinali electron) ay naging upang mangibabaw sa paglipas ng sisingilin particle 380,000 taon pagkatapos ng Big Bang—isang kapanahunan na tinatawag na recombination, kapag ang pagpapalawak ng Uniberso cooled sapat upang payagan ang mga electron upang maging naka-attach sa nuclei.
Dahil ang Big Bang, na ginawa walang carbon o mas mabibigat na elemento, atomic nuclei ay pinagsama sa mga bituin sa pamamagitan ng proseso ng nuclear fusion upang makabuo ng higit pang mga ng ang mga elemento ng helium, at (sa pamamagitan ng ang triple alpha proseso) ang pagkakasunud-sunod ng mga elemento mula sa carbon hanggang sa bakal; tingnan ang mga stellar mga kabataan para sa mga detalye.
Mga elemento ng mas mabibigat na kaysa sa bakal ay ginawa sa supernovae sa pamamagitan ng r-proseso at sa AGB bituin sa pamamagitan ng ang s-proseso, ang parehong na kung saan may kasangkot pagkuha ng neutrons sa pamamagitan ng atomic nuclei. ang mga Elemento tulad ng mga lead na nabuo higit sa lahat sa pamamagitan ng radioactive pagkabulok ng mga mabibigat na elemento.
Lupa
[baguhin | baguhin ang wikitext]Ang karamihan ng mga atoms na bumubuo sa Daigdig at ang kanyang mga naninirahan ay naroroon sa kanilang mga kasalukuyang form sa nebula na pinaliit ng isang molecular ulap sa form na ang Solar System. Ang natitira ay ang resulta ng radioactive pagkabulok, at ang kanilang mga kamag-anak na proporsyon ay maaaring gamitin upang matukoy ang edad ng Mundo sa pamamagitan ng radiometric dating.[37] ang Karamihan ng mga elemento sa crust ng Earth (tungkol sa 99% ng helium mula sa gas wells, tulad ng ipinapakita sa pamamagitan nito mas mababang kasaganaan ng helium-3) ay isang produkto ng alpha pagkabulok.
Mayroong ilang mga bakas ng mga atoms sa Lupa na ay hindi naroroon sa umpisa (ibig sabihin, hindi "mula sa simula"), o mga resulta ng radioactive pagkabulok. Carbon-14 ay patuloy na binuo sa pamamagitan ng cosmic ray sa kapaligiran. ang Ilang mga atoms sa Lupa ay artipisyal na binuo sa alinman sa sadyang o bilang sa pamamagitan ng-produkto ng nuclear reactors o pagsabog. Ng transuranic mga elemento—ang mga may atomic numero ng mas malaki kaysa sa 92—lamang plutoniyum at neptunium mangyari nang natural sa Lupa. Transuranic mga elemento ng radioactive lifetimes mas maikli kaysa sa kasalukuyang edad ng Mundo[38] at sa gayon ay makikilalang mga dami ng mga sangkap na ito ay mahaba dahil bulok, na may pagbubukod ng mga bakas ng plutoniyum-244 posibleng idineposito sa pamamagitan ng cosmic dust.[37] Natural na deposito ng plutoniyum at neptunium ay ginawa sa pamamagitan ng neutron makuha sa yureyniyum mineral.
Ang Lupa ay naglalaman ng humigit-kumulang 1.33×1050 atoms. Kahit na maliit na bilang ng mga independiyenteng mga atoms ng mga marangal na gas na umiiral, tulad ng argon, neon, at helium, 99% ng ang kapaligiran ay nakasalalay sa anyo ng mga molecule, kabilang ang mga carbon dioxide at populasyon ng pilipinas noong taong oxygen at nitrogen. Sa ibabaw ng Earth, ang isang napakalaki karamihan ng mga atoms pagsamahin upang bumuo ng iba ' t-ibang compounds, kabilang ang tubig, asin, silicates at oxides. Mga Atoms ay maaari ring pagsamahin upang lumikha ng mga materyales na hindi binubuo ng hiwalay na mga molecule, kabilang ang mga kristal at mga likido o solid na riles. Ang atomic bagay form sa network ng mga kaayusan na kakulangan ng mga partikular na uri ng maliit na-scale magambala sa pagkakasunud-sunod na nauugnay sa molecular mga bagay na ito.[39]
Bihirang at manilay-nilay mga form
[baguhin | baguhin ang wikitext]Superheavy mga elemento
[baguhin | baguhin ang wikitext]Habang isotopes na may atomic numero ng mas mataas kaysa sa lead (82) ay kilala upang maging radioactive, isang "isla ng katatagan" ay iminungkahi para sa ilang mga elemento na may atomic numero sa itaas 103. Ang mga superheavy mga elemento ay maaaring magkaroon ng isang nucleus na ay relatibong matatag laban sa radioactive pagkabulok. Ang mga pinaka-malamang na kandidato para sa isang matatag na superheavy atom, unbihexium, ay 126 protons at 184 neutrons.
Mga kakaibang bagay
[baguhin | baguhin ang wikitext]Ang bawat maliit na butil ng bagay ay may kaukulang antimatter maliit na butil sa tapat ng mga de-koryenteng singil. Kaya, ang mga positron ay isang positibo sisingilin antielectron at ang antiproton ay isang negatibong sisingilin katumbas ng isang proton. Kapag ang isang bagay at kaukulang antimatter maliit na butil matugunan, sila ay puksain ang isa ' t isa. Dahil sa mga ito, kasama ang isang kawalan ng timbang sa pagitan ng mga bilang ng mga bagay na ito at antimatter particle, ang huli ay bihirang sa uniberso. Ang unang sanhi ng kawalan ng timbang na ito ay hindi pa ganap na nauunawaan, kahit na ang mga teorya ng baryohenesis ay maaaring mag-alok ng isang paliwanag. Bilang isang resulta, walang antimatter atoms ay natuklasan sa likas na katangian. Gayunpaman, sa 1996 ang antimatter kamukhang-mukha ng hydrogen atom (antihydrogen) ay na-synthesize sa CERN laboratoryo sa Geneva.
Iba pang galing sa ibang bansa mga atoms ay nilikha sa pamamagitan ng pagpapalit ng isa ng ang protons, neutrons o mga electron sa iba pang mga particle na may parehong mga singil. Halimbawa, ang isang elektron ay maaaring mapalitan sa pamamagitan ng isang mas malaki muon, na bumubuo ng isang muonic atom. Ang mga uri ng mga atoms ay maaaring gamitin upang subukan ang mga pangunahing mga hula ng pisika.
Tingnan din
[baguhin | baguhin ang wikitext]Mga tala
[baguhin | baguhin ang wikitext]- ↑ For more recent updates see Interactive Chart of Nuclides (Brookhaven National Laboratory) Naka-arkibo 2020-07-25 sa Wayback Machine..
- ↑ A carat is 200 milligrams. By definition, carbon-12 has 0.012 kg per mole. The Avogadro constant defines 7023600000000000000♠6×1023 atoms per mole.
Mga sanggunian
[baguhin | baguhin ang wikitext]- ↑ Pullman, Bernard (1998). The Atom in the History of Human Thought. Oxford, England: Oxford University Press. pp. 31–33. ISBN 978-0-19-515040-7.
{{cite book}}: Invalid|ref=harv(tulong)CS1 maint: date auto-translated (link) - ↑ Cohen, Henri; Lefebvre, Claire, mga pat. (2017). Handbook of Categorization in Cognitive Science (ika-Second (na) edisyon). Amsterdam, The Netherlands: Elsevier. p. 427. ISBN 978-0-08-101107-2.
{{cite book}}: Invalid|ref=harv(tulong)CS1 maint: date auto-translated (link) - ↑ Andrew G. van Melsen (1952). From Atomos to Atom. Mineola, NY: Dover Publications. ISBN 978-0-486-49584-2.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Dalton, John. "On the Absorption of Gases by Water and Other Liquids", in Memoirs of the Literary and Philosophical Society of Manchester. 1803. Retrieved on August 29, 2007.
- ↑ Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. pp. 1–7. ISBN 978-0-19-851567-8. OCLC 48753074.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Thomson, J. J. (Agosto 1901). "On bodies smaller than atoms". The Popular Science Monthly: 323–335. Nakuha noong 2009-06-21.
{{cite journal}}: CS1 maint: date auto-translated (link) - ↑ Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. pp. 228–230. ISBN 978-0-19-851971-3.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. pp. 205–226. ISBN 978-0-19-530573-9.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ TED-Ed (16 Setyembre 2014). "What is the Heisenberg Uncertainty Principle? - Chad Orzel".
{{cite web}}: CS1 maint: date auto-translated (link) - ↑ Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (ika-1st (na) edisyon). Springer. pp. 39–42. ISBN 978-3-540-20631-6. OCLC 181435713.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. p. 8. ISBN 978-0-521-57507-2. OCLC 224032426.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. pp. 33–37. ISBN 978-0-19-521833-6. OCLC 223372888.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. p. 63. ISBN 978-0-387-23284-3. OCLC 228384008.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. pp. 330–336. ISBN 978-1-86094-250-1. OCLC 45900880.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. pp. 10–17. ISBN 978-0-8247-0834-4. OCLC 123346507.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Smirnov, Boris M. (2003). Physics of Atoms and Ions. Springer. pp. 249–272. ISBN 978-0-387-95550-6.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Sills, Alan D. (2003). Earth Science the Easy Way. Barron's Educational Series. pp. 131–134. ISBN 978-0-7641-2146-3. OCLC 51543743.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ CRC Handbook (2002).
- ↑ Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry (PDF) (ika-2nd (na) edisyon). Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. p. 70. ISBN 978-0-632-03583-0. OCLC 27011505.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Ghosh, D. C.; Biswas, R. (2002). "Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii". Int. J. Mol. Sci. 3 (11): 87–113. doi:10.3390/i3020087.
{{cite journal}}: CS1 maint: date auto-translated (link) - ↑ Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation (ika-5th (na) edisyon). Houghton Mifflin. ISBN 978-0-618-34342-3. OCLC 173081482. Inarkibo mula sa orihinal noong 4 Marso 2008. Nakuha noong 5 Pebrero 2008.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Bethe, Hans (1929). "Termaufspaltung in Kristallen". Annalen der Physik. 3 (2): 133–208. Bibcode:1929AnP...395..133B. doi:10.1002/andp.19293950202.
{{cite journal}}: CS1 maint: date auto-translated (link) - ↑ Birkholz, Mario (1995). "Crystal-field induced dipoles in heteropolar crystals – I. concept". Z. Phys. B. 96 (3): 325–332. Bibcode:1995ZPhyB..96..325B. doi:10.1007/BF01313054.
{{cite journal}}: CS1 maint: date auto-translated (link) - ↑ Birkholz, M.; Rudert, R. (2008). "Interatomic distances in pyrite-structure disulfides – a case for ellipsoidal modeling of sulfur ions]". Physica Status Solidi B. 245 (9): 1858–1864. Bibcode:2008PSSBR.245.1858B. doi:10.1002/pssb.200879532.
{{cite journal}}: CS1 maint: date auto-translated (link) - ↑ Birkholz, M. (2014). "Modeling the Shape of Ions in Pyrite-Type Crystals". Crystals. 4 (4): 390–403. doi:10.3390/cryst4030390.
{{cite journal}}: CS1 maint: date auto-translated (link) - ↑ Padilla, Michael J.; Miaoulis, Ioannis; Cyr, Martha (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey: Prentice-Hall, Inc. p. 32. ISBN 978-0-13-054091-1. OCLC 47925884.
There are 2,000,000,000,000,000,000,000 (that's 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Feynman, Richard (1995). Six Easy Pieces. The Penguin Group. p. 5. ISBN 978-0-14-027666-4. OCLC 40499574.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ L'Annunziata, Michael F. (2003). Handbook of Radioactivity Analysis. Academic Press. pp. 3–56. ISBN 978-0-12-436603-9. OCLC 16212955.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Liang, Z.-P.; Haacke, E. M. (1999). Webster, J. G. (pat.). Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging. Bol. vol. 2. John Wiley & Sons. pp. 412–426. ISBN 978-0-471-13946-1.
{{cite book}}:|volume=has extra text (tulong)CS1 maint: date auto-translated (link) - ↑ Fowles, Grant R. (1989). Introduction to Modern Optics. Courier Dover Publications. pp. 227–233. ISBN 978-0-486-65957-2. OCLC 18834711.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Beyer, H. F.; Shevelko, V. P. (2003). Introduction to the Physics of Highly Charged Ions. CRC Press. pp. 232–236. ISBN 978-0-7503-0481-8. OCLC 47150433.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ oxford dictionary – valency
- ↑ Goodstein, David L. (2002). States of Matter. Courier Dover Publications. pp. 436–438. ISBN 978-0-13-843557-8.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Myers, Richard (2003). The Basics of Chemistry. Greenwood Press. p. 85. ISBN 978-0-313-31664-7. OCLC 50164580.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Choppin, Gregory R.; Liljenzin, Jan-Olov; Rydberg, Jan (2001). Radiochemistry and Nuclear Chemistry. Elsevier. p. 441. ISBN 978-0-7506-7463-8. OCLC 162592180.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Lequeux, James (2005). The Interstellar Medium. Springer. p. 4. ISBN 978-3-540-21326-0. OCLC 133157789.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ 37.0 37.1 Manuel 2001, pp. 407–430, 511–519.
- ↑ Zaider, Marco; Rossi, Harald H. (2001). Radiation Science for Physicians and Public Health Workers. Springer. p. 17. ISBN 978-0-306-46403-4. OCLC 44110319.
{{cite book}}: CS1 maint: date auto-translated (link) - ↑ Pauling, Linus (1960). The Nature of the Chemical Bond. Cornell University Press. pp. 5–10. ISBN 978-0-8014-0333-0. OCLC 17518275.
{{cite book}}: CS1 maint: date auto-translated (link)
Panlabas na mga link
[baguhin | baguhin ang wikitext]- "A Look Inside the Atom". American Institute of Physics. 2018. Nakuha noong 2018-04-13.
{{cite web}}: CS1 maint: date auto-translated (link) - Sharp, Tim (8 Agosto 2017). "What is an Atom?". Live Science. Nakuha noong 13 Abril 2018.
{{cite web}}: CS1 maint: date auto-translated (link) - Anonymous (3 Enero 2006). "Hitchhikers Guide to the Universe, Atoms and Atomic Structure". h2g2. BBC. Nakuha noong 13 Abril 2018.
{{cite web}}: CS1 maint: date auto-translated (link) - Various (3 Enero 2006). "Physics 2000, Table of Contents". University of Colorado. Inarkibo mula sa orihinal noong 14 Enero 2008. Nakuha noong 11 Enero 2008.
{{cite web}}: CS1 maint: date auto-translated (link) - Various (3 Pebrero 2006). "What does an atom look like?". University of Karlsruhe. Inarkibo mula sa orihinal noong 17 Abril 2010. Nakuha noong 12 Mayo 2008.
{{cite web}}: CS1 maint: date auto-translated (link)
